Traitement de la pathologie hémorroïdaire : les nouvelles recommandations
Objectifs pédagogiques
- Connaître les indications et la place des traitements médicaux
- Connaître les différents types de traitements instrumentaux de la maladie hémorroïdaire et leurs indications
- Savoir quand recourir à un geste chirurgical pour le traitement de la maladie hémorroïdaire et quel type de chirurgie proposer
- Pouvoir proposer des algorithmes simples de prise en charge thérapeutique en fonction de la nature des plaintes et de l’aspect anatomique des hémorroïdes
Introduction
La pathologie hémorroïdaire est une affection bénigne qui s’exprime par des manifestations fonctionnelles intermittentes. Comme elles ne sont pas spécifiques, elles ne doivent être traitées comme telles que si elles sont clairement en rapport avec une maladie hémorroïdaire. L’examen clinique est donc nécessaire au diagnostic.
La pathologie hémorroïdaire externe se manifeste sous forme de thromboses qui peuvent laisser place à des marisques lorsque le caillot disparaît. Les hémorroïdes internes se manifestent par des rectorragies et/ou un prolapsus, plus rarement par une thrombose.
L’objectif du traitement est de soulager les symptômes. Il ne peut être appliqué qu’avec l’accord du patient qui doit être informé du risque d’échec et des possibles effets secondaires. Les dernières recommandations pour la pratique clinique du traitement de la maladie hémorroïdaire complètent celles de 2001 [1] et font le point sur la prise en charge [2]. Elles précisent les grades de recommandation, A (preuve scientifique établie), B (présomption scientifique) et C (faible niveau de preuve).
Traitements médicaux de la maladie hémorroïdaire
Traitements locaux
Les traitements topiques sont disponibles sous forme de suppositoires, de crèmes ou de pommades. Ils contiennent des corticoïdes locaux, un anesthésique, un phlébotrope, un lubrifiant et/ou un protecteur mécanique.
Une étude contrôlée a permis de montrer l’absence de nocivité et un bénéfice de 90 % chez des patients avec symptômes hémorroïdaires traités par topiques locaux [3]. L’absence de bénéfice à long terme et d’action préventive démontrée sur de nouvelles poussées ne permet pas de conseiller leur utilisation prolongée.
On dispose de peu de données dans la littérature mais les topiques [3] semblent bien tolérés
Les traitements topiques sont recommandés en cas de manifestation aiguë de la maladie hémorroïdaire (grade B) [2]. Il n’y a pas d’étude étayant clairement l’intérêt respectif des différents composants. Il semble cependant utile de prescrire des produits avec corticoïdes en cas d’œdème et d’inflammation (thrombose hémorroïdaire) et ceux avec anesthésique en cas de douleur.
Traitements par voie générale
Les modificateurs du transit visent à réguler la consistance ou la fréquence des selles. Ils associent selon les recommandations habituelles [4, 5] un apport suffisant en fibres alimentaires parfois aidé par un ajout de mucilages, de laxatifs osmotiques ou de freinateurs du transit en fonction du trouble du transit.
L’apport de fibres alimentaires par l’alimentation ou par des laxatifs de type mucilage diminue de moitié le saignement et la récidive des symptômes de la maladie hémorroïdaire avec un bénéfice qui persiste au minimum trois mois [4, 5].
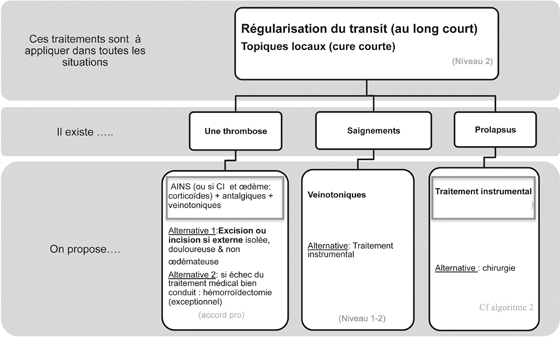
La régularisation du transit est recommandée en cas de symptômes liés à la maladie hémorroïdaire interne et externe, en curatif mais aussi en préventif (grade B) [2]. L’objectif est la régularisation du transit. C’est la seule mesure préventive au long cours ayant une efficacité démontrée sur les symptômes hémorroïdaires. La constipation étant le trouble du transit le plus fréquemment en cause, son traitement est une priorité sur le long terme. La prise en charge d’une diarrhée pour diminuer le nombre d’évacuations irritantes semble tout aussi importante.
L’utilisation des phlébotropes est basée sur le concept physiopathologique impliquant la composante vasculaire des hémorroïdes. Ce sont la diosmine, la troxérutine, les dérivés du Ginkgo biloba, l’hydroxyl-éthylrutoside.
Deux méta-analyses récentes [6, 7] montrent un bénéfice à l’utilisation des phlébotropes pour le prurit, les rectorragies et le suintement liés à la maladie hémorroïdaire. La diosmine à fortes doses dans sa forme micronisée abrège et atténue les symptômes aigus de la maladie hémorroïdaire interne et le risque de récurrence à moyen terme (6 mois) [6]. D’autres substances (troxérutine, dérivés du Ginkgo biloba, hydroxyl-éthylrutosides) ont été comparées à la diosmine sans différence significative d’efficacité sur les symptômes.
Il persiste un doute sur l’absence de biais de publication (carence de publication des essais négatifs) et une définition parfois imprécise du type de pathologie hémorroïdaire étudiée.
S’il n’est pas rapporté d’effet secondaire notable [6, 7], des cas de colites lymphocytaires ont été décrits.
Les phlébotropes sont recommandés en cas de manifestation aiguë de la maladie hémorroïdaire (excepté le prolapsus) à court terme (grade A) [2].
Les anti-inflammatoires non stéroïdiens (AINS) agissent sur la douleur et l’inflammation, les antalgiques périphériques et centraux (éventuellement associés aux AINS) peuvent être prescrits en cas de douleur insuffisamment contrôlée, les corticoïdes per os en cas de thrombose externe œdémateuse avec contre-indication aux AINS (accord professionnel) [2].
En pratique
Malgré l’absence de données publiées, la co-prescription est fréquente dans la pratique [8]. En cas de thrombose hémorroïdaire, il est recommandé de proposer un traitement comportant des AINS, des antalgiques, des régulateurs du transit et des topiques. En cas de pathologie hémorroïdaire interne, il est recommandé de proposer un traitement comportant des régulateurs du transit et des topiques, les phlébotropes sont autorisés (accord professionnel) [2].
Cas particuliers
En cas de fissure anale, le traitement associant laxatifs et topiques locaux peut traiter les deux pathologies. En cas de suppuration anale et de colite inflammatoire, leur traitement prime sur celui des hémorroïdes.
Il n’y a pas lieu de modifier les traitements locaux ou généraux de la maladie hémorroïdaire en cas de prise –d’antiagrégants plaquettaires, d’anticoagulants, ou d’immunodépression.
La pathologie hémorroïdaire touche une femme sur 5 après l’accouchement et une sur dix durant la grossesse [9]. Il s’agit essentiellement de thromboses hémorroïdaires externes plus ou moins œdémateuses relevant en général d’un traitement médical. Seule la régularisation du transit est légitime pour espérer diminuer le risque de poussée.
Le Centre de Référence sur les Agents Tératogènes (www.lecrat.org) permet l’utilisation des traitements locaux, du paracétamol, des laxatifs et des phlébotropes dans la pathologie hémorroïdaire chez la femme enceinte ou allaitante. Les AINS sont à éviter dès le début de la grossesse et sont formellement contre-indiqués à partir du début du 6e mois (24SA) et jusqu’à l’accouchement. Ils peuvent être utilisés pendant l’allaitement. En période de gestation et après l’accouchement, les corticoïdes per os peuvent être utilisés en cure courte à toutes les périodes en cas de thrombose hémorroïdaire œdémateuse. Si un antalgique est nécessaire on privilégie le paracétamol, quel que soit le terme de la grossesse. La morphine ne doit être prescrite qu’en cure courte et pas plus de trois jours en période d’allaitement. Pendant l’allaitement, on utilise en première intention le paracétamol ou le tramadol pendant les 72 premières heures puis la codéine en cas de besoin. Ces données doivent impérativement être actualisées avant prescription en se référant au site du CRAT.
La pathologie hémorroïdaire est très rare chez l’enfant. Il importe surtout de faire le diagnostic différentiel, en premier lieu la fissure anale. Il semble que les traitements locaux et les laxatifs peuvent être prescrits. En cas de thrombose hémorroïdaire (exceptionnelle), les AINS peuvent être utilisés pour traiter la douleur.
Traitement instrumental de la maladie hémorroïdaire
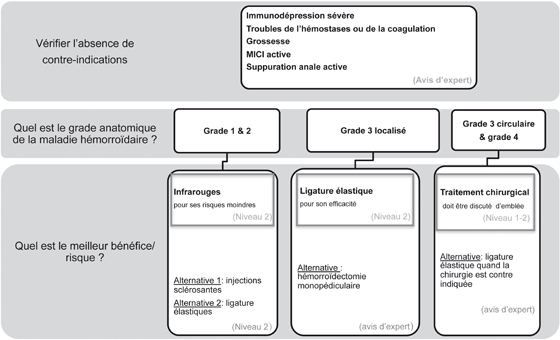
On appelle traitement instrumental les méthodes appliquant un procédé chimique ou physique qui permettent de traiter la maladie hémorroïdaire interne responsable de rectorragies ou d’un prolapsus de grades 2 ou 3 [10].
Les thromboses hémorroïdaires, externes et/ou internes, ne sont pas des indications au traitement instrumental.
Le principe commun à ces traitements instrumentaux consiste à provoquer au sommet des plexus hémorroïdaires internes une fibrose cicatricielle dont les conséquences sont doubles : fixation de la muqueuse anale au plan musculaire sous-jacent et obturation du réseau vasculaire sous-muqueux issu de l’artère rectale supérieure. Les moyens rapportés dans la littérature sont soit chimiques (injections sclérosantes), soit thermiques (photocoagulation infrarouge, électrocoagulation bipolaire ou monopolaire, cryothérapie, thermosonde), soit mécaniques (ligature élastique). Cette dernière ajoute de fait une réduction du prolapsus muco-hémorroïdaire.
Quelle que soit la technique utilisée, et sauf emploi d’un dispositif à usage unique toujours préférable, le matériel doit être stérilisé après chaque utilisation selon les normes en vigueur. Tout matériel à usage unique ne doit jamais être réutilisé.
Photocoagulation infrarouge
Elle nécessite un photocoagulateur à rayons infrarouges qui transforme en chaleur le rayonnement émis par une ampoule de tungstène focalisé sur une tige en quartz au point d’application. Deux à trois points de photocoagulation sont appliqués à la base de chacun des pédicules hémorroïdaires. La cicatrisation obtenue en 3 semaines induit une coagulation des capillaires et une fibrose cicatricielle. Le nombre de séance est de 2 à 4, l’intervalle admis entre deux séances est de 4 semaines [2].
Indications
La photocoagulation infrarouge est recommandée en cas de saignements expliqués par une maladie hémorroïdaire grades 1 et 2 après échec du traitement médical (grade A) [2].
Résultats
À court terme, à six et douze semaines, il n’existe pas de différence significative entre les différents traitements instrumentaux, que les symptômes soient les rectorragies ou le prolapsus modéré. Les résultats sont comparables, avec une disparition ou une amélioration des symptômes dans 70 à 90 % des cas [11, 12]. À un an, l’efficacité de la photocoagulation infrarouge tombe à 40 % [13].
Complications et séquelles
Seuls des effets secondaires mineurs ont été rapportés, à type de gêne transitoire dans 20 à 35 % des cas, de douleurs modérées ne dépassant pas 48 heures dans 4 à 8 % des cas, et de rectorragies minimes ou de suintement séro-hémorragique pendant une dizaine de jours dans 5 à 25 % des cas [13]. Des saignements plus abondants par chute d’escarre ont pu être exceptionnellement constatés aux alentours du 10e jour après la procédure. La prescription pendant quelques jours d’un mucilage associé à des suppositoires anti-hémorroïdaire peut être conseillée.
Ligature élastique
Elle nécessite un ligateur et un système à aspiration. Elle doit être réalisée à au moins un centimètre au-dessus de la ligne pectinée. Les tissus ligaturés conduisent à la formation d’une escarre dont la cicatrisation se fait en 2 à 3 semaines. Le rythme entre deux ligatures successives est d’une séance toutes les 4 semaines, en se limitant à un total de 3 ou 4 séances. Les résultats après une triple ligature en une seule séance [14] sont comparables à ceux de trois ligatures en trois séances successives (grade A) [2].
Indications
Les ligatures élastiques sont recommandées en cas de rectorragies (grade A) [2] et de prolapsus hémorroïdaire modéré, ou limité à un seul paquet en cas d’hémorroïdes internes grades 2 et 3 (grade B) [2].
En cas de rectorragies sans prolapsus, la ligature élastique ne doit être proposée qu’en seconde intention, après échec du traitement normalisant le transit intestinal dont l’efficacité à 3 mois est similaire [15] et probablement après échec de la photocoagulation infrarouge, aux résultats comparables avec moins d’effets secondaires et de complications [11, 16].
Lorsque le symptôme dominant est le prolapsus, la ligature peut être d’emblée proposée en raison de sa supériorité démontrée, en particulier sur le long terme [12]. En l’absence de contre-indication, les ligatures élastiques peuvent être proposées avant la chirurgie mais elles sont moins efficaces sur le prolapsus de grade 3 circulaire et inefficaces sur le prolapsus de grade 4 [12, 17, 18].
Résultats
À court terme, on note une disparition ou une amélioration des symptômes dans 70 à 90 % des cas [11, 12]. À un an et surtout trois ans, l’efficacité des ligatures élastiques est significativement supérieure à celle de la photocoagulation infrarouge, 40 % à un an [13] et aux injections sclérosantes, 28 % à 2 ans [12], avec un bénéfice toujours présent dans 70 % à 90 % des cas (hémorroïdes hémorragiques non prolabées ou prolapsus modérés). La supériorité des ligatures est plus nette en cas prolapsus, en moins de séances que pour les autres techniques [12, 13, 16].
En cas de prolapsus de grade 2, la ligature élastique peut être proposée avant une hémorroïdectomie pédiculaire car aussi efficace sur les rectorragies, la douleur, le prurit et le suintement [19]. Cependant, à quatre ans, la satisfaction des patients traités par ligature élastique se dégrade. L’hémorroïdopéxie est plus efficace que la ligature élastique dans les prolapsus de grade 2 [20].
En cas de prolapsus de grade 3, l’hémorroïdectomie pédiculaire et l’hémorroïdopexie sont plus efficaces que la ligature élastique et doivent lui être préférées [17-19].
Complications et séquelles
Les effets indésirables mineurs sont très fréquents (douleurs et/ou de rectorragies de faible abondance) et peuvent persister pendant une semaine [21]. La prescription d’un antalgique de classe OMS 1 ou 2 est recommandée, associée si nécessaire à un régulateur du transit [2]. La survenue d’une douleur immédiate très intense peut être la conséquence d’une ligature posée trop près de la ligne pectinée, imposant l’ablation de l’élastique. Des symptômes vagaux sont décrits jusqu’à 30 % des patients au décours immédiat de la procédure [21].
Des complications sont possibles (1 à 5 % des cas) : thrombose hémorroïdaire interne ou externe, dysurie ou plus rarement rétention aiguë d’urines, algies majeures, abcès péri anal [14, 22]. Une hémorragie sévère jusque 15 jours après la ligature nécessitant un geste d’hémostase est rapportée dans 0,2 à 1,2 % des cas [22]. Plus de vingt cas de complications infectieuses très graves, essentiellement des cellulites pelviennes, ont été publiées dans la littérature [23]. Le patient doit être averti des signes précoces associant douleurs anorectales et troubles urinaires entre le 2e et le 7e jour après la ligature. Il n’y a pas de consensus sur l’intérêt d’une antibioprophylaxie systématique en cas de ligatures élastiques. Il est cependant licite de la faire, notamment chez les sujets à risque infectieux tels diabétiques et en immunodépression (accord professionnel AP3) [2].
Ces effets indésirables très fréquents et ces complications potentiellement graves justifient la remise au patient d’une fiche d’information écrite avant toute ligature élastique qui ne doit pas être réalisée lors d’une première consultation.
Injections sclérosantes
La technique nécessite une seringue à usage unique couplée à une allonge de 10 cm. L’injection est indolore et ne doit être ni trop superficielle (œdème blanchâtre), ni trop profonde (douleurs). Deux injections par séance sont conseillées, en des sites diamétralement opposés, dirigées vers la base des pédicules hémorroïdaires internes. Le rythme entre deux séances successives le plus souvent retenu est de 2 à 4 semaines, en se limitant à un total de 2 ou 4 séances [2]. Actuellement seul le chlorhydrate double de quinine et d’urée (Kinuréa H®) a l’AMM, l’huile phéniquée à 5 % utilisée par les auteurs anglo-saxons ayant été retirée de la commercialisation en France.
Indications
Les injections sclérosantes sont recommandées en cas de saignements expliqués par une maladie hémorroïdaire grades 1 et 2 après échec du traitement médical (grade A) [2].
Résultats
À court terme, on note une disparition ou une amélioration des symptômes dans 70 à 90 % des cas [11, 12]. À un an et surtout trois ans, l’efficacité des ligatures élastiques est significativement supérieure aux injections sclérosantes qui est de 28 % à 2 ans [12].
Complications et séquelles
Les complications sévères et les séquelles sont rares [11] : douleurs modérées ou pesanteurs transitoires (9 à 70 %), rectorragies minimes (2 à 10 %) et rares suintements [11, 13]. La prescription d’un antalgique de classe OMS 1 ou 2 peut être conseillée, associée si nécessaire à un régulateur du transit [2].
Plusieurs cas de complications infectieuses graves ont été rapportés et 3 cas d’impuissance, précédée par une hémospermie ou une hématurie, ont été décrits après injection en zone prostatique. D’après ces éléments, une antibioprophylaxie poursuivie durant 3 jours peut être conseillée (avis d’expert) [2].
Cas particuliers
Une maladie inflammatoire intestinale active et une suppuration ano-périnéale sont des contre-indications aux traitements instrumentaux. En cas de grossesse et d’immunodépression sévère, les ligatures élastiques et les injections sclérosantes sont contre-indiquées (accord professionnel) [2]. Le traitement instrumental est considéré comme à risque hémorragique faible selon les recommandations de bonne pratique [24]. De ce fait, l’aspirine n’a pas besoin d’être interrompue même si un sur-risque hémorragique ne peut être exclu [22]. Les anticoagulants, les autres antiagrégants plaquettaires et une coagulopathie sévère augmentent le risque de saignement.
Autres traitement instrumentaux
La faible diffusion et la pauvreté des données de la littérature ne permettent pas d’apprécier correctement l’efficacité sur les symptômes ni l’importance des effets indésirables [1, 2].
Par ailleurs, l’absence d’études spécifiques entraîne de fait une contre-indication à leur application en cas de pathologie proctologique associée, de grossesse, de déficit immunitaire, de maladie inflammatoire chronique de l’intestin et de prise d’anticoagulants, d’antiagrégants plaquettaires ou de trouble de la coagulation. Seules la cryothérapie et l’électrocoagulation bipolaire (Bicap®) peuvent être réalisées sous aspirine [24].
Cryothérapie
La cryothérapie utilise le froid pour obtenir une nécrose du tissu muco-hémorroïdaire [25]. Elle a été décrite selon différentes modalités. La cryothérapie dirigée se fait en association à une ligature élastique pour accélérer le processus de nécrose. La cryothérapie directe brève (cryosclérose) se fait par application sus hémorroïdaire de la cryode pendant 2 à 3 minutes. L’application plus longue (cryochirurgie), ayant pour objectif une nécrose plus profonde, semble progressivement abandonnée. Aucune de ces méthodes n’a cependant fait l’objet d’études -comparatives contrôlées. Les effets secondaires sont fréquents liés au mode d’action imprécis sur l’extension en profondeur des lésions induites : suintement anal quasi constant, douleurs dans 30 %, rectorragies importantes dans 5 % des cas. La cryothérapie est de moins en moins utilisée [1, 2].
Électrocoagulation bipolaire
L’électrocoagulation bipolaire, ou diathermie bipolaire de contact, utilise un appareil en forme de pistolet (Bicap®). Deux à six impulsions sont délivrées, entraînant une zone de coagulation souvent large. L’ensemble des paquets hémorroïdaires peut être traité en une seule séance, qui peut être renouvelée 3 à 4 semaines après [26].
L’efficacité de l’électrocoagulation bipolaire sur les saignements est -comparable à celle de la photocoagulation infrarouge mais moins bonne que celle des ligatures élastiques [27, 28] et au prix d’effets indésirables et de complications plus importants : gêne anale presque constante [26], douleurs modérées à intenses dans 10 à 28 % des cas [26, 27] et rectorragies nécessitant une hémostase chirurgicale dans 8 % des cas [26]. L’utilisation de cette technique à une forte intensité doit donc rester prudente et la douleur être prévenue.
Traitement chirurgical de la maladie hémorroïdaire
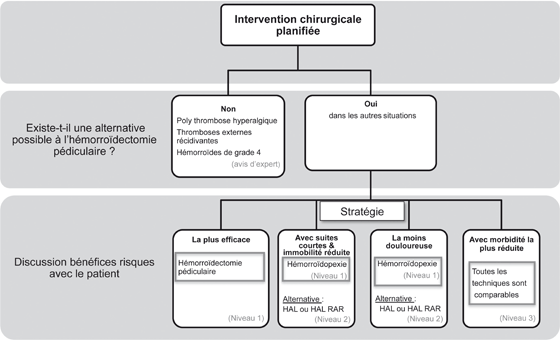
Le traitement chirurgical est indiqué en cas d’échec du traitement médical et/ou instrumental. Il peut parfois être indiqué d’emblée.
Les trois principales méthodes sont l’hémorroïdectomie pédiculaire, technique de référence, l’hémorroïdopexie circulaire ou technique de Longo et la ligature artérielle guidée par Doppler (DGHAL) associée ou non à une mucopexie, alternative mini invasive.
L’hémorroïdectomie pédiculaire
Elle consiste à réséquer le tissu hémorroïdaire selon les 3 axes anatomiques artériels en préservant des ponts cutanéo-muqueux entre les plaies opératoires. Il existe des variantes techniques selon le traitement des ponts, l’ajout d’une anoplastie muqueuse postérieure, le mode de traitement des plaies opératoires qui peuvent être fermées ou laissées ouvertes.
Indications
L’hémorroïdectomie pédiculaire est recommandée quel que soit le grade de la maladie hémorroïdaire (grade A) [2]. Elle peut être indiquée d’emblée en cas de complication aiguë (poly thrombose hyperalgique et/ou nécrotique résistant au traitement médical), d’une anémie sévère, et de maladie hémorroïdaire grade 4.
Résultats
L’hémorroïdectomie est efficace sur tous les types de manifestations liés à la maladie hémorroïdaire (thromboses, prolapsus, hémorragie). Le traitement chirurgical est supérieur à la ligature élastique sur la résolution des symptômes (RR 1,68 (1 à 2,83)) [17]. La technique fermée permet une cicatrisation plus rapide (différence moyenne : 1,2 semaine) sans différence en terme d’efficacité, de durée d’hospitalisation, de douleur postopératoire ni de taux de complications comparativement à la technique ouverte [27]. L’utilisation du Ligasure permet un gain en ce qui concerne le temps opératoire, la douleur postopératoire, et la reprise des activités avec un taux global de complications similaires [28, 29].
Complications et séquelles
La douleur postopératoire (DPO) doit être distinguée de celle survenant à la première selle. Elle n’est pas différente selon que les plaies sont fermées ou non [27]. Elle est surtout diminuée jusqu’à la 24e heure grâce aux infiltrations ou blocs pudendaux pratiqués en début d’intervention avec des agents à demi-vie longue [30]. L’utilisation de ciseaux, d’un bistouri froid ou de l’électrocoagulation n’influence pas la DPO [2]. La DPO précoce est moins importante avec le Ligasure [28, 29].
La fréquence du fécalome après hémorroïdectomie est évaluée à 2 % [1].
La rétention urinaire est définie de façon variable selon les auteurs : simple dysurie ou rétention nécessitant un sondage. Dans tous les cas, elle augmente la durée d’hospitalisation [31]. Un sondage urinaire est nécessaire dans 0,5 % à 53 % des cas.
Les suppurations locales compliquent 0,5 % des hémorroïdectomies [32].
Les marisques sont des séquelles d’une maladie hémorroïdaire externe ou conséquence d’une réaction inflammatoire postopératoire du tissu hémorroïdaire résiduel sous les ponts cutanéo-muqueux. Leur fréquence après hémorroïdectomie varie de 1 à 21 % [33]. Bien qu’aucune donnée objective ne soit disponible, il est recommandé par certains l’épluchage des ponts cutanéo-muqueux permettant l’ablation du maximum de tissu hémorroïdaire.
Un retard de cicatrisation peut survenir sans que la fréquence ne soit appréciée dans la littérature.
En cas d’hémorragie, un geste d’hémo-stase n’est nécessaire que dans moins de 4 % des cas [1]. Le risque hémorragique est de 8,5 % dans une récente série prospective ayant inclus 375 patients [34]. Dans les méta-analyses, ce risque, quelle qu’en soit son importance, est de 4,2 à 15 % pour l’hémorroïdectomie ouverte, semblable à celui de l’hémorroïdopexie [35-37].
La complication infectieuse redoutable mais exceptionnelle est la gangrène de Fournier qui impose une prise en charge médico-chirurgicale en urgence [38].
La sténose anale a une fréquence dans les grandes séries inférieure à 4 %. Dans les méta-analyses, le taux de sténose rapporté varie de 0 à 7,5 % [37]. Les interventions réalisées en urgence ne sont pas plus sténosantes [1]. Elle peut intéresser la partie haute ou la partie basse du canal anal. Son délai moyen de constitution est de 6 semaines. Le plus souvent, elle est traitée médicalement (dilatation anale) parfois par plastie cutanée ou muqueuse (anoplastie), pouvant être associée à une sphinctérotomie. Le traitement préventif passe par le respect des principes de base de la technique (avec préservation de ponts larges), le maintien d’un transit intestinal normal et la surveillance régulière des plaies pour éviter leur accolement trop précoce.
La fréquence exacte de l’incontinence anale postopératoire est diversement évaluée et sujette à controverse, entre 2 et 12 % [28, 39]. La méta-analyse de Laughlan rapporte une fréquence de l’incontinence anale temporaire à 5,5 % [37] : le plus souvent, il s’agit d’une incontinence passive aux gaz, parfois aux selles liquides, ou d’un suintement. Dans une série de 633 malades suivis prospectivement pendant 1 an, le score médian d’incontinence de Jorge et Wexner n’était pas modifié (2/20), une incontinence anale de novo était observée chez 8,5 % des patients mais 16,7 % des malades ayant des troubles de la continence en préopératoire avaient vu ce symptôme disparaître après la chirurgie [40].
Les facteurs de risque d’incontinence anale liés au geste chirurgical sont la dilatation anale et la sphinctérotomie interne latérale ; les lésions occultes du sphincter interne et/ou externe (plus fréquentes chez les patients hémorroïdectomisés se plaignant d’incontinence) ; l’utilisation d’un écarteur de Parks, ouvert de 4 cm (qui abaisse significativement la pression de repos à 6 et 12 semaines) [2].
À ces facteurs opératoires s’ajoutent les facteurs liés au terrain : l’existence d’un syndrome de l’intestin irritable, d’un antécédent de traumatisme obstétrical ou d’une neuropathie sont à prendre en compte à l’occasion de l’évaluation préopératoire.
Cas particuliers
La chirurgie des hémorroïdes pendant la grossesse et dans le post-partum immédiat est à réserver aux complications sévères (thrombose hyperalgique et/ou nécrotique, anémie aiguë) et résistant au traitement médical qui reste le traitement de première intention (avis d’expert).
Au cours des maladies inflammatoires chroniques, il existe un risque élevé de complications en phase active. Il est proposé de n’opérer qu’en dernier recours, uniquement en phase quiescente, en l’absence d’atteinte ano–rectale évolutive et de suppuration, en privilégiant les gestes partiels mono pédiculaires [2].
Les progrès actuels réalisés en matière de traitement antirétroviraux rendent possibles la chirurgie hémorroïdaire lorsqu’elle est nécessaire chez les malades infectés par le VIH en bon état général. Il n’y a pas de données dans la littérature concernant les patients immunodéprimés.
Le risque hémorragique après chirurgie anale sous anticoagulants et antiagrégants est peu évalué dans la littérature. Dans une série prospective, le risque relatif hémorragique était de 2,08 (0,33-3,82), P = 0,02 [34]. Ce risque est toujours à mettre en balance avec celui cardiovasculaire lié à l’arrêt des anticoagulants.
L’hémorroïdectomie est un geste à risque modéré pouvant « être réalisé avec poursuite du traitement par aspirine lorsque l’état cardiologique l’impose. Les données manquant pour le clopidogrel, il est proposé de remplacer après accord cardiologique le clopidogrel par de l’acide acétyle salicylique cinq jours avant le geste chirurgical. La reprise éventuelle du clopidogrel sera à discuter à J30 (dès que possible en cas de bithérapie), de manière à couvrir la période d’hémorragie par chute d’escarre. Pour le prasugrel, l’arrêt pourrait être discuté après accord cardiologique selon les mêmes modalités que pour le clopidogrel mais à J-7, la chirurgie se faisant alors sous acide acétyle salicylique, avec une reprise du prasugrel à J30 » [24].
L’hémorroïdopexie agrafée (ou anopexie) circulaire
Décrite par Antonio Longo, elle consiste à réséquer une collerette muqueuse circulaire au sommet des hémorroïdes internes avec une pince mécanique qui assure dans le même temps la résection et une suture muco muqueuse par agrafage circulaire.
Indications
L’hémorroïdopexie agrafée circulaire est une alternative à l’hémorroïdectomie pour la maladie hémorroïdaire interne symptomatique de grades 2 et 3 (grade A) [2].
Deux essais randomisés comparant l’hémorroïdopexie à l’hémorroïdectomie effectuée en urgence en cas de thrombose hémorroïdaire interne montrent un léger avantage pour l’hémorroïdopexie en terme de douleur postopératoire [2] de récidive et de satisfaction.
Du fait de son mode d’action, l’hémorroïdopexie n’est pas indiquée en cas d’hémorroïdes externes.
Résultats
Comparativement à l’hémorroïdectomie conventionnelle, l’hémorroïdopexie expose globalement à plus de symptômes à long terme qu’après hémorroïdectomie [41, 42]. La récidive du prolapsus est globalement plus fréquente après hémorroïdopexie [35-37, 41, 42] avec pour une étude [36], une différence qui n’apparaît qu’après 16 mois de suivi. On constate plus de récidives de prolapsus et plus de nouveau geste (chirurgical ou non) pour prolapsus, même si l’on élimine de l’analyse les études n’incluant que des malades avec une procidence grade 4. Le risque relatif de récidive de prolapsus après hémorroïdopexie circulaire dans toutes les méta-analyses est compris entre 3 et 5 dans le suivi à long terme.
Si l’on isole les malades avec un prolapsus grade 3, l’efficacité de l’hémorroïdopexie reste globalement inférieure à celle de l’hémorroïdectomie [36, 42].
Les malades avec un prolapsus de grade 4 ont un taux de récidive après hémorroïdopexie tellement élevé par rapport à l’hémorroïdectomie pédiculaire que cette intervention n’est pas recommandée dans cette situation [43].
Complications et séquelles
Le taux global et le taux spécifique des complications qu’elles soient immédiates (rétention urinaire, thrombose, hémorragie) [35, 36] ou tardives (sténose, incontinence, urgences) [35, 36, 41-43] sont identiques avec l’hémorroïdectomie pédiculaire et l’hémorroïdopexie circulaire.
La douleur postopératoire précoce après hémorroïdopexie est moins élevée qu’après hémorroïdectomie, devenant quasi nulle pour les deux techniques au-delà de 21 jours [35, 36].
Le risque de sténose anale est plus important en cas d’agrafage circulaire bas situé ou prenant de façon circonférentielle l’épaisseur de la musculeuse (avis d’expert). Le plus souvent, elle est traitée médicalement (dilatation anale).
Une incontinence transitoire est décrite pour environ 4 % des malades quelle que soit la technique, elle est proche de zéro lors des suivis à long terme [35, 36, 41, 42]. Le patient doit être prévenu de la survenue fréquente d’urgences fécales, d’évacuations fragmentées et de fausses envies qui s’estompent progressivement.
Il existe des complications spécifiques à l’hémorroïdopexie, exceptionnelles qu’il faut connaître : perforation rectale hématome péri-rectale nécessitant une reprise chirurgicale en urgence.
Cas particuliers
Il faut respecter les règles usuelles de la chirurgie hémorroïdaire quelle que soit la technique employée concernant la femme enceinte, le patient immunodéprimé, le patient atteint de maladie intestinale inflammatoire, de troubles de la coagulation, sous traitement agissant sur la coagulation.
La ligature artérielle guidée par Doppler (DGHAL)
La ligature artérielle a pour but de « désartérialiser » les hémorroïdes en diminuant de façon sélective le flux artériel des plexus hémorroïdaires tout en évitant de gêner le retour veineux. On la distingue de la mucopexie ou recto anal repair (RAR®) qui fixe le plexus hémorroïdaire prolabé. Au lieu d’exciser les hémorroïdes, le principe est donc de diminuer leur taille et de restaurer les rapports anatomiques des plexus hémorroïdaires dans le canal anal.
Il existe sur le marché différent appareils : HAL RAR® de AMI, Anuphone® de Legrand et THD®. En cas de DGHAL, 7 à 9 ligatures artérielles sont réalisées en moyenne (durée moyenne d’intervention de 20 à 30 mn). En cas HAL-RAR®, le nombre moyen de mucopexie est de 2 à 3, à adapter à chaque patient (durée moyenne d’intervention de 35 à 45 mn).
Indications
La DGHAL est recommandée en cas maladie hémorroïdaire interne grades 2 et 3 symptomatique (grade B) [2]. La ligature artérielle seule est déconseillée en cas de grade 4 (grade C) [2]. L’association mucopexie/ligature artérielle donne de meilleurs résultats que la ligature seule sur le prolapsus et les rectorragies à court et à long terme chez les patients avec une maladie hémorroïdaire grades 3 [44] et 4 [45]. Le DGHAL associé à la mucopexie peut être proposé en alternative à l’hémorroïdopexie (niveau 2) (grade B) [2].
L’intérêt de la technique a été noté chez des patients ayant une maladie de Crohn sans atteinte rectale et en urgence en cas d’hémorragie hémorroïdaire sévère non contrôlée par le traitement médical.
Du fait de son mode d’action, la DGHAL n’est pas indiquée en cas d’hémorroïdes externes.
Résultats
La plupart des séries évaluant la DGHAL associée ou non à la mucopexie sont prospectives observationnelles utilisant le matériel HAL-RAR® de AMI et THD®.
En cas de DGHAL seule, l’efficacité globale est de 92 % à un an et 73 % à 5 ans [47]. En cas de mucopexie associée, l’efficacité globale est de 91 % à 15 mois [44] et 88 % à 38 mois [45]. Une revue de la littérature a repris 28 études (2 904 patients) : 21 séries, 5 essais randomisés et 2 suivis comparatifs de cohortes. La plupart précisait le grade de prolapsus, essentiellement 2 et 3. Vingt-quatre concernaient la DGHAL et sept la DGHAL associée à une mucopexie. La récidive était en moyenne de 17,5 % [3-60] : les rectorragies 13,8 % [2,6-27], le prolapsus 9,4 % [4-29] et les douleurs 3,3 à 10 %. La récidive à 5 ans était de 12 % en cas de grade 2 et 31 % en cas de grade 3 [48]. La récidive du prolapsus est plus fréquente en cas de prolapsus de grade 3 (et surtout de grade 4) opérés par DGHAL.
L’explication physiopathologique de la récidive hémorragique serait la grande variabilité de vascularisation des plexus hémorroïdaires [49]. Le plus souvent, les récidives sont contrôlées par un traitement conservateur. Parfois un geste chirurgical, identique ou autre (hémorroïdectomie, anopexie agrafée circulaire), est nécessaire.
La satisfaction des patients est de 94 % à 15 mois et 89 % à 38 mois et plus de 90 % des patients opérés referaient la même intervention [44].
Trois études ont comparé la DGHAL à l’hémorroïdectomie pédiculaire (suivi de un an). Les deux premières, la comparant à l’hémorroïdectomie fermée, concluaient à une efficacité similaire avec moins de douleurs et une durée d’hospitalisation plus courte [50, 51]. La dernière étude a comparé chez 114 patients l’hémorroïdectomie au Ligasure et la DGHAL avec mucopexie. Elle conclut à une efficacité similaire sur le contrôle de la douleur et du prolapsus (96 %) mais avec des suites plus simples [52].
Les études randomisées comparant la DGHAL (associée ou pas à une mucopexie) à l’anopexie agrafée circulaire concluent à une efficacité similaire avec une moindre morbidité et des suites opératoires plus simples : moins de douleurs, de complications hémorragiques (4 % vs 11 %) et une reprise plus rapide des activités. Une méta-analyse confirme ces résultats [53].
Récemment, 2 équipes se sont interrogées sur l’intérêt du Doppler. Elles ont comparé la DGHAL associée à une mucopexie au geste de mucopexie adaptée seule [54] et la DGHAL à une ligature guidée par la vue [55] : l’efficacité est similaire, avec moins de -douleurs lorsque les ligatures et les mucopexies sont réalisées sous simple contrôle de la vue. Si la première étude ne comparait pas la technique de mucopexie recommandée, la deuxième avait un suivi très court et un faible nombre de ligature, expliquant le mauvais résultat dans les deux groupes. À ce jour, on ne peut remettre en cause l’intérêt du Doppler d’autant qu’il a été montré que réaliser des ligatures à l’aveugle (à 1, 3, 5, 7, 9 et 11 heures) faisait manquer chez un tiers des patients au moins une artère hémorroïdale [56].
Complications et séquelles
La DGHAL et la mucopexie sont des techniques dont la morbidité est faible, sans mortalité rapportée à ce jour.
Les complications immédiates sont le plus souvent mineures à de type saignement (5 % [0-29]), douleurs (15 % [0-38) et thromboses (1,5 à 7 %) [48]. Les douleurs sont plus fréquentes (18,5 %) en cas de mucopexie ou de geste complémentaire (type exérèse de marisque) associé. Les autres complications immédiates sont la dyschésie (1,8 %), la rétention d’urines (5,5 %), les fistules (0,5 %) et l’hématome sous-muqueux (3,7 %) [48, 57]. Les complications plus tardives sont les thromboses hémorroïdaires (3 %) et la fissure anale (1,6 %).
Cas particuliers
Il faut respecter les règles usuelles de la chirurgie hémorroïdaire quelle que soit la technique employée concernant la femme enceinte, le patient immunodéprimé, le patient atteint de maladie intestinale inflammatoire, de troubles de la coagulation, sous traitement -agissant sur la coagulation. Certains auteurs ont mis l’accent sur les complications hémorragiques chez les patients avec troubles de l’hémostase [57]. D’autres n’ont pas noté une augmentation de l’incidence des accidents hémorragiques chez les patients prenant des anticoagulants et antiagrégants [45].
Tableau I. Classification anatomique de la maladie hémorroïdaire
|
Présentation anatomique |
Présentation clinique |
|
Grade 1 |
Hémorroïdes congestives non prolabées |
|
Grade 2 |
Hémorroïdes se prolabant lors de la défécation (ou lors d’un effort) et se réintégrant spontanément après le passage de la selle |
|
Grade 3 |
Hémorroïdes se prolabant lors de la défécation (ou lors d’un effort) et nécessitant une réintégration manuelle |
|
Grade 4 |
Hémorroïdes prolabées en permanence ne pouvant pas |
Algorithmes de prise en charge (Figs 1, 2 et 3)
Si les symptômes motivent un traitement, le grade anatomique oriente le choix du traitement. La tendance actuelle inclus dans la décision thérapeutique, notamment chirurgicale, le choix du patient entre la technique la plus efficace, la moins morbide ou permettant une reprise rapide des activités habituelles [2].
Figure 1. Traitement de la maladie hémorroïdaire.
La maladie hémorroïdaire est documentée par un examen clinique et les autres étiologies sont écartées
Figure 2. Traitement instrumental de la maladie hémorroïdaire.
Il existe une maladie hémorroïdaire interne chronique et récidivante non contrôlée par le traitement médical
(régulation transit et veinotoniques)
Figure 3. Traitement chirurgical de la maladie hémorroïdaire.
Il existe une maladie hémorroïdaire chronique invalidante
pour laquelle les traitements instrumentaux sont inefficaces ou non recommandés
Références
- Abramowitz L, Godeberge P, Staumont G, et al. Clinical practice guidelines for the treatment of hemorrhoid disease. Société Nationale Françoise de Colo-Proctologie (SNFCP). Gastroenterol Clin Biol 2001 Jun-Jul; 25(6-7):674-702.
- Higuero T, Abramowitz L, Staumont G, et al. Clinical practice guidelines for the treatment of hemorrhoid disease. Société Nationale Françoise de Colo-Proctologie (SNFCP). In Press.
- Jiang Z, Tang W, Cao J, et al. Double-blind randomized clinical trial in evaluating the efficacy and safety of rectum mucosa protector in the treatment of acute hemorrhoids. Chin J Surg 2001;39:53-5.
- Alonso-Coello P, Guyatt G, Heels-Ansdell D, et al. Laxatives for the treatment of hemorrhoids. Cochrane Database Syst Rev 2005 Oct 19;(4):CD004649. Review.
- Alonso-Coello P, Mills E, Heels-Ansdell D, et al. Fiber for the treatment of hemorrhoids complications: a systematic review and meta-analysis. Am J Gastroenterol 2006 Jan;101(1):181-8. Review.
- Alonso-Coello P, Zhou Q, Martinez-Zapata MJ, et al. Meta-analysis of flavonoids for the treatment of haemorrhoids. Br J Surg 2006 Aug; 93(8):909-20. Review.
- Perera N, Liolitsa D, Iype S, et al. Phlebotonics for haemorrhoids. Cochrane Database Syst Rev 2012 Aug 15;8:CD004322. Review.
- Madoff RD, Fleshman JW. American Gastroenterological Association technical review on the diagnosis and treatment of hemorrhoids.; Clinical Practice Committee, American Gastroenterological Association. Gastroenterology 2004 May;126(5):1463-73.
- Abramowitz L, Sobhani I, Benifla JL, et al. Anal fissure and thrombosed external hemorrhoids before and after delivery. Dis Colon Rectum 2002 May;45(5):650-5.
- Coulom P. Non surgical therapy of hemorrhoids. Gastroenterol Clin Biol 2009;33(10-11 Suppl):F20-6.
- Johanson JF, Rimm A. Optimal nonsurgical treatment of hemorrhoids: a comparative analysis of infrared coagulation, rubber band ligation, and injection sclerotherapy. Am J Gastroenterol 1992;87:1600-6.
- MacRae HM, McLeod RS. Comparison of hemorrhoidal treatment modalities. A meta-analysis. Dis Colon Rectum 1995;38:687-94.
- Walker AJ, Leicester RJ, Nicholls RJ, Mann CV. A prospective study of infrared coagulation, injection and rubber band ligation in the treatment of haemorrhoids. Int J Colorect Dis 1990;5:113-6.
- Poon GP, Chu KW, Lau WY, Lee JM, Yeung C, Fan ST, Yiu TF, Wong SH, Wong KK. Conventional versus triple rubber band ligation for hemorrhoids. A prospective, randomized trial. Dis Colon Rectum 1986;29: 836-8.
- Ho YH, Tan M, Seow-Choen F. Micronized purified flavonidic fraction compared favorably with rubber band ligation and fiber alone in the management of bleeding hemorrhoids: randomized controlled trial. Dis Colon Rectum 2000;43:66-9.
- Gupta PJ. Infrared coagulation versus rubber band ligation in early stage hemorrhoids. Braz J Med Biol Res 2003;36:1433-9.
- Shanmugam V, Thaha MA, Rabindranath KS, Campbell, KL, Steele RJC, Loudon MA. Systematic review of randomized trials comparing rubber band ligation with excisional haemorrhoidectomy. Br J Surg 2005;92: 1481-7.
- Peng BC, Jayne DG, Ho YH. Randomized trial of rubber band ligation vs. stapled hemorrhoidectomy for prolapsed piles. Dis Colon Rectum 2003;46:291-7.
- Murie JA, Sim AJ, Mackenzie I. The importance of pain, pruritus and soiling as symptoms of haemorrhoids and their response to haemorrhoidectomy or rubber band ligation. Br J Surg 1981;68:247-9.
- Shanmugam V, Muthukumarasamy G, Cook JA, Vale L, A. J. M. Watson AJM, Loudon MA. Randomized controlled trial comparing rubber band ligation with stapled haemorrhoidopexy for Grade II circumferential haemorrhoids: long-term results. Colorectal Disease 2010;12:579-86.
- Watson NFS, Liptrott S, Maxwell-Armstrong CA. A prospective audit of early pain and patient satisfaction following out-patient band ligation of haemorrhoids. Ann R Coll Surg Engl 2006;88:275-9.
- Bat L, Melzer E, Koler M, Dreznick Z, Shemesh E. Complications of rubber band ligation of symptomatic internal hemorrhoids. Dis Colon Rectum 1993;36:287-90.
- McCloud JM, Jameson JS, Scott AN. Life-threatening sepsis following treatment for haemorrhoids: a systematic review. Colorectal Dis 2006;8:748-55.
- SFED/HAS. Antiagrégants plaquettaires : prise en compte des risques thrombotique et hémorragique en cas de geste endoscopique chez le coronarien (Recommandation de Bonne Pratique en partenariat avec la Haute Autorité de Santé, juin 2012). 2012; Available from: http://www.sfed.org/documents_sfed/files/recommandations/Antiagregplaqendo_rbp.pdf.
- Lewis AA, Rogers HS, Leighton M. Trial of maximal anal dilatation, cryotherapy and elastic band ligation as alternatives to haemorrhoidectomy in the treatment of large prolapsing haemorroids. Br J Surg 1983;70: 54-6.
- Randall GM, Jensen DM, Machicado GA, et al. Prospective randomized comparative study of bipolar versus direct current electrocoagulation for treatment of bleeding internal hemorrhoids. Gastrointest Endosc 1994;40:403-10.
- Dennison A, Whiston RJ, Rooney S, Chadderton RD, Wherry DC, Morris DL. A randomized comparison of infrared photocoagulation with bipolar diathermy for the outpatient treatment of hemorrhoids. Dis Colon Rectum 1990;33:32-4.
- Jutabha R, Jensen D, Chavalitdhamrong D. Randomised prospective study of endoscopic rubber band ligation compared with bipolar coagulation for chronical bleeding internal hemorrhoids. Am J Gastroenterol 2009;104:2057-64.
- Ho YH, Buettner PG. Open compared with closed haemorrhoidectomy: meta-analysis of randomized controlled trials. Tech Coloproctol 2007 Jun;11(2):135-43.
- Nienhuijs SW, de Hingh IH. Pain after conventional versus Ligasure haemorrhoidectomy. A meta-analysis. Int J Surg 2010;8(4): 269-73.
- Milito G, Cadeddu F, Muzi MG, Nigro C, Farinon AM. Haemorrhoidectomy with Ligasure vs conventional excisional techniques: meta-analysis of randomized controlled trials. Colorectal Dis 2010 Feb;12(2):85-93.
- Vinson-Bonnet B, Coltat JC, Fingerhut A, Bonnet F. Local infiltration with ropivacaine improves immediate postoperative pain control after hemorrhoidal surgery. Diseases of the Colon and Rectum 2002;45:104-8.
- Toyonaga T, Matsushima M, Sogawa N, Jiang SF, Matsumura N, Shimojima Y, et al. Postoperative urinary retention after surgery for benign anorectal disease: potential risk factors and strategy for prevention. Int J Colorectal Dis 2006 Oct;21(7):676-82.
- Bleday R, Pena JP, Rothenberger DA, Goldberg SM, Buls JG. Symptomatic hemorrhoids: current incidence and complications of operative therapy. Dis Colon Rectum 1992 May;35(5):477-81.
- Gravie JF, Lehur PA, Huten N, Papillon M, Fantoli M, Descottes B, et al. Stapled hemorrhoidopexy versus milligan-morgan hemorrhoidectomy: a prospective, randomized, multicenter trial with 2-year postoperative follow up. Ann Surg 2005 Jul;242(1):29-35.
- Pigot F, Juguet F, Bouchard D, Castinel A, Vove JP. Prospective survey of secondary bleeding following anorectal surgery in a consecutive series of 1,269 patients. Clin Res Hepatol Gastroenterol 2011 Jan;35(1):41-7.
- Shao WJ, Li GC, Zhang ZH, Yang BL, Sun GD, Chen YQ. Systematic review and meta-analysis of randomized controlled trials comparing stapled haemorrhoidopexy with conventional haemorrhoidectomy. Br J Surg 2008 Feb;95(2):147-60.
- Burch J, Epstein D, Sari AB, Weatherly H, Jayne D, Fox D, et al. Stapled haemorrhoidopexy for the treatment of haemorrhoids: a systematic review. Colorectal Dis 2009 Mar;11(3):233-43; discussion 43.
- Laughlan K, Jayne DG, Jackson D, Rupprecht F, Ribaric G. Stapled haemorrhoidopexy compared to Milligan-Morgan and Ferguson haemorrhoidectomy: a systematic review. Int J Colorectal Dis 2009 Mar;24(3):335-44.
- Karadeniz Cakmak G, Irkorucu O, Ucan BH, Karakaya K. Fournier’s Gangrene after Open Hemorrhoidectomy without a Predisposing Factor: Report of a Case and Review of the Literature. Gastroenterol 2009;3(2):147-55.
- Ommer A, Wenger FA, Rolfs T, Walz MK. Continence disorders after anal surgery – a relevant problem? Int J Colorectal Dis 2008 Nov;23(11):1023-31.
- Bouchard D, Abramowitz L, Castinel A, Suduca JM, Staumont G, Soudan D, et al. One-year outcome of haemorrhoidectomy: A prospective multicentre french study. Colorectal Dis 2013 Jun;15(6):719-26.
- Jayaraman S, Colquhoun PH, Malthaner RA. Stapled hemorrhoidopexy is associated with a higher long-term recurrence rate of internal hemorrhoids compared with conventional excisional hemorrhoid surgery. Dis Colon Rectum 2007;50:1297-305.
- Lumb KJ, Colquhoun PH, Malthaner R, Jayaraman S. Stapled versus conventional surgery for hemorrhoids. Cochrane Database of Systematic Reviews 2006, Issue 4.
- Giordano P, Gravante G, Sorge R, Ovens L, Nastro P. Long-term outcomes of stapled hemorrhoidopexy vs conventional hemorrhoidectomy: a meta-analysis of randomized controlled trials. Arch Surg 2009 Mar;144(3): 266-72.
- Theodoropoulos GE, Sevrisarianos N, Paconstantinou J, et al. Doppler-guided haemorrhidal artery ligation, rectoanal repair, sutured haemorrhoidopexy and minimal mucocutaneous excision for grade III-IV haemorrhoids: a multicenter prospective study of safety and efficacy. Colorectal Dis 2010;12:125-34.
- Faucheron JL, Gangner Y, Doppler-guided hemorrhoidal artery ligation and rectoanal repair (HAL-RAR) for the treatment of grade IV hemorrhoids: long-term results in 100 consecutive patients. Dis Colon Rectum 2011;54:226-31.
- Avital S, Inbar R, Karin E, Greenberg R. Five-year follow-up of Doppler-guided hemorrhoidal artery ligation Tech Coloproctol 2012; 16:61-5.
- Pucher PH, Sodergren MH, Lord AC, Darzi A, Ziprin P. Clinical outcome following Doppler-guided haemorrhoidal artery ligation: a systematic review Colorectal Disease 15, e284-e294
- Schuurman JP, Go PM, Bleys RL. Anatomical branches of the superior rectal artery in the distal rectum. Colorectal Dis 2009;11: 967-71.
- Bursics A, Morvay K, Kupcsulik P, Flautner L. Comparison of early and 1-year follow-up results of conventional hemorrhoidectomy and hemorrhoid artery ligation: a randomized study Int J Colorectal Dis 2004;19: 176-80.
- Zagryadskiy E, Gorelov S. Transanal Doppler-guided Hemorrhoidal Artery Ligation and Recto Anal Repair vs Closed Hemorrhoidectomy for treatment of grade III-IV hemorrhoids. A randomized trial Pelviperineology 2011;30:107-12.
- Zampieri N, Castellani R, Andreoli R, Geccherle A. Long-term results and quality of life in patients treated with hemorrhoidectomy using two different techniques: Ligasure versus transanal hemorrhoidal dearterialization. Am J Surg 2012;204: 684-8.
- Sajid MS, Parampalli U, Whitehouse P, Sains P, McFall MR, M. Baig K. A systematic review comparing transanal haemorrhoidal de-arterialisation to stapled haemorrhoidopexy in the management of haemorrhoidal disease. Tech Coloproctol 2012;16:1-8.
- Gupta PJ, Kalaskar S, Taori S, Heda PS. Doppler-guided hemorrhoidal artery ligation does not offer any advantage over suture ligation of grade 3 symptomatic hemorrhoids. Tech Coloproctol 2011;15:439-44.
- Schuurman JP, Rinkes I, Go P. Hemorrhoidal artery ligation procedure with or without Doppler transducer in grade II and III hemorrhoidal disease. Ann Surg 2012;255:840-5.
- Avital S, Inbar R, Karin R, Greenberg R. Is Doppler ultrasonography essential for hemorrhoidal artery ligation? Tech Coloproctol 2012;16:291-4.
- Giordano P, Overton J, MAdeddu F, Zaman S, Gravante G. Transanal desarterialization: a systematic review. Dis Colon Rectum 2009;52:1665-71.
Les Cinq points forts
-
La régulation du transit apporte un bénéfice sur les saignements et sur la récidive des symptômes ; les topiques et les phlébotropes peuvent être utilisés en cure courte en cas de manifestation aiguë de la maladie hémorroïdaire.
-
En raison de sa relative innocuité, la photocoagulation infrarouge pourrait être la technique de première intention sur les hémorroïdes hémorragiques non prolabées.
-
La ligature peut être recommandée devant une procidence hémorroïdaire modérée ou localisée avant de proposer une chirurgie.
-
L’hémorroïdectomie pédiculaire est recommandée quel que soit le grade de la maladie hémorroïdaire. Elle peut être indiquée d’emblée en cas de complication aiguë, d’une anémie sévère et de maladie hémorroïdaire grade 4.
-
La DGHAL et l’hémorroïdopexie agrafée circulaire (Intervention de Longo) sont recommandées en cas de maladie hémorroïdaire de grades 2 et 3.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION