TEP/IRM. Progrès technologiques et applications cliniques en oncologie digestive
Objectifs pédagogiques
- Connaître les principes du TEP/IRM et son apport par rapport au TEP/TDM
- Connaître lesmodalités pratiques de réalisation du TEP/IRM
- Connaître l’intérêt actuel du TEP/IRM en oncologie
- Connaître les données actuellement disponibles du TEP/IRMpour le bilan initial et le suivi des pathologies oncologiques digestives
Introduction
Le concept de machine hybride TEP/IRM a été proposé dès les années 90, bien avant les premières installations de TEP/TDM. Depuis, de nombreux progrès technologiques ont permis l’utilisation de cette combinaison, d’abord chez le petit animal, puis chez l’homme. L’évolution du TEP/IRM diffère de celle du TEP/TDM, modalité qui a initialement répondu à un besoin clinique avant d’être adaptée à l’imagerie du petit animal. Le TEP/TDM est un grand succès médical et économique avec plus de 5 000 systèmes installés dans le monde aujourd’hui. Au cours des 3 années qui ont suivi son introduction sur le marché en 2001, plus de 500 systèmes ont été installés. En comparaison, l’adoption du TEP/IRM est beaucoup plus lente. Après l’introduction du premier prototype en 2007 (conçu pour l’imagerie cérébrale), le premier système corps entier n’a été disponible qu’en 2011. Deux systèmes TEP/IRM entièrement intégrés ont ensuite été commercialisés en 2011 et 2014. Cinq ans après son introduction sur le marché, on comptabilise aujourd’hui plus de 100 TEP/IRM installées à travers le monde, dont trois en France.
L’avantage de l’intégration du TEP et de l’IRM repose sur l’acquisition simultanée d’une part d’images « moléculaires » (répartition d’un radiotraceur ciblant une voie métabolique) et d’autre part, d’images IRM anatomiques de haute résolution et à fort contraste, ainsi que des paramètres d’imagerie fonctionnelle. De nombreux auteurs évoquent aujourd’hui le potentiel de cette combinaison innovante, ainsi que les nombreuses applications en recherche fondamentale. Une enquête récente [1] à propos des modes d’utilisation du TEP/IRM par les premiers utilisateurs du système a ciblé 39 sites internationaux ayant scanné près de 45 000 patients. Cette enquête montre que l’oncologie est l’indication majoritaire, loin devant la neurologie. Les principales pathologies oncologiques étudiées sont les cancers du pelvis, de la prostate et de la tête et du cou. Les applications cardiovasculaires et les pathologies inflammatoires sont évoquées comme de futures voies de travail. Au-delà de son utilisation clinique, l’autre défi à relever sera de démontrer que cet outil d’imagerie multiparamétrique peut améliorer la caractérisation « in vivo » des mécanismes mis en jeu dans la progression tumorale, en apportant des informations corrélées ou associées aux caractéristiques histologiques et génétiques des tumeurs.
Nous aborderons dans cet article les challenges technologiques que pose cette machine et les solutions apportées, puis les données cliniques issues de la littérature sur l’apport du TEP/IRM en oncologie, et enfin le retour d’expérience sur l’activité du TEP/IRM du site CEA-SHFJ.
Challenges technologiques et solutions
Considérations techniques et principe des systèmes d’imagerie
Le TEP/IRM permet la combinaison d’informations provenant de sources différentes, l’imagerie moléculaire de la TEP et l’imagerie morphologique et fonctionnelle de l’IRM. Le couplage TEP et IRM fournit des solutions diagnostiques nouvelles, en apportant des éléments complémentaires aux autres techniques d’imagerie, en particulier dans la détection et la caractérisation tumorale. Cette acquisition simultanée de deux techniques d’imagerie n’a pas d’équivalent en imagerie médicale.
Les technologies traditionnellement utilisées dans les détecteurs TEP n’étant pas compatibles avec le champ magnétique de l’IRM, une série de défis technologiques a dû être résolue pour mettre au point les systèmes TEP/IRM [2].
Pour en savoir plus. Les interférences causées par l’IRM sur le fonctionnement du TEP qui sont en rapport avec le champ magnétique perturbant le parcours des électrons dans les tubes photomultiplicateurs ; la chaleur, les courants induits et les vibrations lors des commutations de gradients qui ont nécessité la conception de nouveaux détecteurs TEP ; les interférences électroniques provoquées par les ondes de radiofréquence ; et enfin, le manque d’information sur l’atténuation photonique (pas de donnée scanner) nécessaire à la reconstruction d’images TEP non biaisées. Parallèlement, l’introduction de détecteurs TEP dans l’environnement magnétique de l’IRM peut entraîner des interférences avec les antennes réceptrices, extrêmement sensibles à tout bruit électronique. Ainsi, pour concevoir un système hybride TEP-IRM permettant une acquisition simultanée, le détecteur TEP compatible IRM doit avoir les propriétés suivantes : le système doit avoir une performance comparable à celle des systèmes actuels TEP/TDM, doit pouvoir être inséré à l’intérieur de l’aimant, et les interférences entre les deux systèmes doivent être minimes.
Pour relever ces défis techniques, plusieurs configurations de TEP/IRM ont été proposées, parallèlement au développement de nouveaux détecteurs insensibles au champ magnétique, les photodétecteurs à semi-conducteurs (SSPD en anglais, pour Solid State Photodetectors).
Le système TEP/IRM « séquentiel », développé par Philips Healthcare, combine des dispositifs TEP et IRM 3 Tesla installés dans une même pièce et séparés d’une distance d’environ 3 mètres l’un de l’autre, mais connectés par un lit d’examen unique, pivotant de 180° et permettant un déplacement du patient sans que sa position ne change entre les deux examens. Afin de minimiser les interférences, des éléments protecteurs isolent l’électronique et les photomultiplicateurs du TEP des effets du champ magnétique de l’IRM.
La société Siemens Medical a développé le premier système TEP/IRM « intégré » (Biograph mMR) incorporant dans une seule machine les systèmes TEP et IRM et permettant une acquisition 3D simultanée du corps entier. L’anneau de détection TEP est situé à l’intérieur de l’IRM 3 Tesla (entre les bobines de gradient et l’antenne « corps » de radiofréquence), conduisant à un champ de vue de 60 cm × 25 cm, et composé de détecteurs de type photodiodes à avalanche (APD). La résolution temporelle de ces détecteurs (2.93 ns) ne permet pas d’utiliser l’information temps de vol, qui améliore le rapport signal sur bruit des images avec un effet d’autant plus important que la résolution temporelle des détecteurs est meilleure.
En 2014, après avoir proposé un système tri-modalité (TEP/TDM et IRM séparés), la société General Electrics (GE) a commercialisé un système hybride de dernière génération (Signa PET/MR), qui intègre des photodétecteurs de type SiPM (Silicon Photomultipliers) permettant d’accéder à la technologie du temps de vol. La partie IRM fonctionne dans cet environnement sans dégradation des performances. Cette machine est installée actuellement sur deux sites en France, au CEA-SHFJ à Orsay et dans le service de médecine nucléaire de l’hôpital La Pitié-Salpêtrière.
Pour en savoir plus. Ce système est constitué d’un IRM 3 Tesla (Discovery 750 w) dont le diamètre de l’anneau est de 70 cm, à l’intérieur duquel sont insérés les détecteurs TEP. Le diamètre intérieur du tunnel pour le patient est de 60 cm et la longueur du champ de vue du TEP de 25 cm. Le détecteur du TEP/IRM Signa est composé de cristaux scintillateurs à base de lutétium, de dimensions 4 × 5,3 × 25 mm. Les caractéristiques [3] du système sont une résolution en énergie de 10,5 %, une résolution temporelle de 390 ps, une résolution spatiale transversale de 4,2 mm, et une sensibilité de 22,5 kcps.MBq-1. La sensibilité élevée est obtenue par la combinaison de facteurs géométriques (épaisseur importante du détecteur, champ de vue transverse de 60 cm et axial de 25 cm) et électroniques (système de récupération des photons diffusés à l’intérieur du détecteur) [4]. Le pic NECR est de 215 kcps à 17 kBq.ml-1.
Verrous méthodologiques
En plus des défis technologiques, une série de verrous méthodologiques doit être levée afin de faciliter le développement des applications cliniques oncologiques du TEP/IRM. Les plus importants que nous aborderons dans ce paragraphe sont la correction d’atténuation, le « workflow », et l’imagerie du parenchyme pulmonaire.
La correction d’atténuation
Les principaux facteurs dégradant l’image TEP sont l’atténuation et la diffusion des photons à l’intérieur du champ de vue. Pour détecter une paire de photons en coïncidence, aucun des deux photons ne doit avoir subi d’atténuation, alors que la fraction atténuée des paires de gamma émises à partir du centre du corps d’un patient peut être supérieure à 90 %. Ainsi, la reconstruction d’images quantitatives en TEP nécessite une correction précise de l’atténuation. Grâce au scanner couplé des machines TEP/TDM, la génération d’une carte de coefficients d’atténuation pour des photons de 511 keV peut être obtenue rapidement, et permettre de corriger de l’atténuation les images d’émission.
Pour en savoir plus. En TEP/IRM, la correction d’atténuation des photons se heurte à plusieurs problèmes :
- Les valeurs d’intensité de l’image IRM reflètent la densité des protons et les propriétés de relaxation tissulaire, sans relation directe entre le signal mesuré en IRM et le coefficient d’atténuation linéaire à 511 keV [5]. Les méthodes de correction d’atténuation en TEP/IRM sont donc basées sur la segmentation des tissus en classes auxquelles sont attribués des coefficients d’atténuation prédéfinis pour chaque classe.
- Les séquences d’IRM standard donnent un signal très faible dans les os (qui est le tissu le plus atténuant dans l’organisme) et le poumon en raison de la faible densité de protons et du T2 très court de ces tissus. Par conséquent, ces différents tissus ne peuvent pas être différenciés sur la base du signal IRM à partir de séquences standard, alors que leurs coefficients d’atténuation gamma respectifs sont très différents.
- Le champ de vue de l’IRM est plus petit que le champ de vue du TEP, ce qui peut entraîner une troncature des bras des patients sur l’IRM.
- Du matériel additionnel tel que les antennes de radiofréquence et les câbles sont présents dans le champ de vue du TEP et sont sources d’atténuation.
La correction d’atténuation en TEP/IRM est aujourd’hui le plus souvent réalisée grâce à des méthodes de segmentation à partir de séquences Dixon, qui donnent des images en pondération eau et graisse. La segmentation permet de délimiter les tissus sans signal (air, tube digestif et poumon), et leur attribuer une valeur de coefficient d’atténuation. Ces méthodes n’intègrent cependant pas l’atténuation par l’os. Des méthodes basées sur des atlas, issues de bases de données comparatives TDM/IRM, peuvent être utilisées au niveau cérébral, pour améliorer la précision de la correction d’atténuation en prenant en compte l’os du crâne. Des travaux sont en cours pour intégrer l’atténuation par l’os dans les méthodes de correction grâce notamment aux séquences à temps d’écho ultra court. Par ailleurs, la présence de corps étrangers ou de matériels ferromagnétiques, entraînant des artéfacts en IRM, peut compliquer aussi la génération de cartes d’atténuation fiables. Des travaux cliniques récents montrent que la visualisation et l’analyse des lésions osseuses ne semblent pas être affectées par une correction d’atténuation ne prenant pas en compte l’os [6], même si une sous-estimation significative de l’activité détectée a été décrite. Ainsi, les méthodes de correction d’atténuation actuelles suffisent pour des examens oncologiques « conventionnels », mais nécessitent encore des améliorations pour optimiser la quantification.
Le « Workflow »
Le « workflow », est la mise en place et la réalisation de protocoles d’exploration optimisés de durée compatible avec une activité clinique de routine, c’est-à-dire de l’ordre de 45 minutes, sans dépasser 1 heure. Les possibilités d’acquisition de multiples séquences au cours d’un même examen sont nombreuses et un équilibre doit être trouvé entre temps d’examen et pertinence des informations pertinentes, afin de répondre à une ou plusieurs questions cliniques. Des travaux sont encore nécessaires pour optimiser le temps d’acquisition en TEP/IRM. Des combinaisons de séquences, spécifiques à chaque indication et type de cancer, devront être sélectionnées en prenant en compte leur caractère redondant ou complémentaire de l’information fournie par la TEP seule. Par exemple, l’utilisation systématique de séquences de diffusion en TEP/IRM est aujourd’hui discutée. En dehors des indications indiscutables comme l’exploration des lésions hépatiques et des atteintes péritonéales, et même si quelques travaux évoquent son avantage dans la stadification ganglionnaire des cancers de la tête et du cou, du poumon ou du col de l’utérus, l’utilisation systématique, à tous les étages, des séquences de diffusion ne semble pas nécessaire. En effet, cette séquence peut être assez longue, parfois conduire à des artefacts dans les images, et peut donner des informations redondantes avec le TEP.
L’imagerie du parenchyme pulmonaire
L’imagerie du poumon en IRM soulève de nombreux défis. Le scanner thoracique reste aujourd’hui la technique de référence pour l’analyse du parenchyme pulmonaire. Le rapport signal/bruit du poumon en IRM est faible du fait de la faible concentration en protons, des différences de susceptibilité magnétique entre l’air et le tissu et des mouvements physiologiques du cœur et de la respiration. Les séquences à temps d’écho ultracourt sont un moyen pour dépasser ces limites. En effet, un temps d’écho (TE) court permet de recueillir rapidement le signal avant sa décroissance. Une étude récente montre un taux de détection de 80 % des nodules pulmonaires > 4 mm avec les séquences à TE ultra rapide, par rapport au taux détecté en scanner X (7). Des optimisations de séquence sont encore nécessaires, mais on peut espérer obtenir dans les années à venir des séquences assez performantes pour l’imagerie pulmonaire des bilans oncologiques.
Données de la littérature
Oncologie générale
Dans de multiples indications oncologiques, et depuis plusieurs années, des données se sont accumulées quant à l’avantage de co-analyser les images IRM et les images TEP réalisées sur des machines séparées pour améliorer les performances et la confiance diagnostique des lecteurs. On peut citer par exemple la stadification du cancer du col [8], la détection des lésions hépatiques [9] ou le bilan des atteintes péritonéales [10].
Le nombre d’études comparant TEP/TDM et TEP/IRM s’accumule depuis les dernières années [11], alors que les premières études ont d’abord montré la faisabilité de l’imagerie TEP/IRM. Les premiers résultats comparatifs indiquent pour le TEP/IRM, une qualité d’image et des performances diagnostiques au moins similaires aux examens TEP/TDM dans des domaines oncologiques variés, tels que les cancers de la prostate, ORL, du sein, et du poumon. Cependant, le temps d’examen, qui dépend essentiellement des séquences IRM réalisées, demeure encore assez conséquent (10-20 min pour un TEP/TDM corps entier contre 30-60 min pour un TEP/IRM). Il faut rappeler que cette durée reste du même ordre que la durée de réalisation de deux examens sur des machines dissociées. Les travaux les plus récents, quant à eux, commencent à démontrer des performances supérieures du TEP/IRM par rapport au TEP/TDM pour la détection des métastases ganglionnaires, hépatiques et osseuses, notamment au cours des cancers pulmonaires [12], des cancers œsophagiens [13], des cancers mammaires [14, 15], et des tumeurs neuro endocrines digestives [16]. En particulier, alors que le scanner est souvent pris en défaut pour la détection des métastases médullaires sans destruction corticale, l’IRM est très sensible pour détecter ce type d’atteinte. L’ensemble de ces résultats montre que l’impact du TEP/IRM sur la prise en charge thérapeutique des patients peut être substantiel. Pour l’illustrer, on peut citer les résultats de Catalano et al. qui rapportent dans leur étude sur 134 patients inclus pour stadification d’une tumeur solide, une modification de leur prise en charge thérapeutique dans 20 % des cas avec l’utilisation du TEP/IRM [17].
Oncologie digestive
Quelques données sont disponibles en oncologie digestive [18, 19]. Les premières études montrent clairement que le TEP/IRM est supérieur au TEP/TDM pour la détection des métastases hépatiques en termes de performances diagnostiques. Cette supériorité est à l’évidence due en grande partie à l’apport de l’IRM qui est la technique de référence pour la détection et la caractérisation des métastases hépatiques [20, 21]. Des comparaisons plus pertinentes ont fait l’objet d’études récentes portant sur le diagnostic des métastases hépatiques. Lee et al. (série de 53 patients) ont montré que le TEP/IRM était plus performant que le scanner injecté seul [22], et Reiner et al. [23] ont montré, sur une série de 55 patients, que le TEP/IRM était aussi performant que le TEP avec scanner injecté, pour le diagnostic de métastases hépatiques. Par ailleurs le bilan pré opératoire des cancers du pancréas a fait l’objet d’une étude comparant TEP/IRM et TEP/TDM injecté chez 37 patients [24]. Le protocole TEP/IRM incluant une IRM pancréatique complète a montré des performances similaires au TEP/TDM injecté en termes de résécabilité tumorale, d’atteinte ganglionnaire et métastatique.
TEP/IRM au CEA-SHFJ. Retour d’expérience
La mise en place du protocole Promise (PET/MR in Oncology and inflaMmatory proceSs) au CEA-SHFJ a débuté en octobre 2015 avec l’installation du PET/MR Signa de GE sur le site du SHFJ, et concerne les développements méthodologiques et apports cliniques du TEP/IRM en imagerie tumorale et inflammatoire. Le promoteur est le Commissariat à l’Energie Atomique et aux Énergies Alternatives (CEA), Numéro IDRCB : 100 035 2015-A01431-48. L’objectif principal est de démontrer que l’exploration en TEP/IRM des cancers solides, par rapport au TEP/TDM, améliore la précision diagnostique, en termes de sensibilité et de spécificité, ainsi que la confiance diagnostique dans l’interprétation des images. À la date du 31/01/2017, plus de 300 patients ont déjà été explorés. Nous présentons deux domaines d’amélioration que sont la possibilité d’examens « tout en un » et l’amélioration de la quantification du signal TEP.
Examens « tout-en-un » (« one stop shop »)
Le TEP-IRM ouvre la possibilité d’examens « tout en un », notamment dans des indications cliniques où les deux examens sont nécessaires, offrant un meilleur confort et une diminution de l’irradiation pour le patient, ainsi qu’une technique d’imagerie potentiellement plus précise pour le médecin interpréteur. Un bénéfice sur le plan économique est aussi envisageable.
Les premiers résultats du protocole montrent que le TEP/IRM peut remplacer le TEP/TDM dans le cadre des bilans oncologiques, avec des examens TEP/IRM simultanés d’une durée d’environ 15 minutes, incluant des coupes fines T2 avec synchronisation respiratoire [25]. La durée peut atteindre environ 25 minutes en cas d’utilisation de séquences de diffusion aux étages thoracique, abdominal et pelvien. La détection, la localisation et la mesure des lésions étaient comparables à celles du TEP/TDM, utilisant un scanner sans contraste. Ainsi, si on cible une durée maximale d’examen TEP/IRM d’environ 45 min, durée raisonnable pour une utilisation en routine clinique, 30 minutes restent disponibles pour l’exploration d’un ou plusieurs organes spécifiques comme le cerveau, le foie, la région tête et cou, ou le pelvis. Ce principe est présenté dans la figure 1.

Figure 1. Proposition d’un protocole standard de bilan oncologique en TEP/IRM. L’examen corps entier est complété par une ou plusieurs acquisitions IRM plus localisées. Dixon : séquence IRM réalisée pour la génération une carte d’atténuation. Ax T2 RT : coupes axiales en pondération T2 avec synchronisation respiratoire
Parmi les applications multiples de ce principe (imagerie corps entier + imagerie d’organe), deux ont été particulièrement étudiées au CEA-SHFJ. Premièrement, le bilan des cancers pulmonaires non à petites cellules : une imagerie corps entier, incluant une imagerie cérébrale et thoracique avec injection, est faisable, dans une durée moyenne de 45 min. La détection des lésions primitives et métastatiques, leur localisation, ainsi que les mesures semi-quantitatives sont comparables à celles du TEP/TDM [25], avec un avantage supplémentaire d’inclure une exploration cérébrale à la recherche de métastases.
Deuxièmement, c’est la restadification des cancers digestifs, notamment colorectaux. Un bilan comprenant une imagerie thoraco-abdomino-pelvienne composée de TEP, de coupes axiales T2 et de diffusion, complétée par une imagerie abdominale post contraste, peut être réalisée en moins de 45 minutes (Fig. 2). Des acquisitions plus ciblées au niveau du rectum (tumeur en place ou en post thérapeutique), ou du pancréas peuvent aussi compléter l’exploration.

Figure 2. Proposition d’un protocole d’exploration pour les bilans de récidives de cancers colorectaux. Loc : séquence Localizer de l’IRM. Ax T2 RT : Coupes axiales en pondération T2 avec synchronisation respiratoire. TAP : thoraco-abdomino-pelvien
Le TEP/IRM pourrait ainsi être utilisé en remplacement du bilan d’imagerie conventionnel des tumeurs solides qui inclut souvent un TEP/TDM, un scanner abdomino-pelvien et/ou une IRM. Cette approche nous semble prometteuse pour les bilans des récidives des cancers digestifs, des cancers mammaires, ORL et pelviens, et potentiellement pour les bilans initiaux des cancers du rectum et du col de l’utérus.
Amélioration de la confiance diagnostique
En couplant l’IRM au TEP, on observe une diminution des faux positifs et des faux négatifs du TEP classiquement observés au cours du TEP/TDM [26]. L’imagerie IRM cérébrale, de la moelle osseuse et hépatique simultanée et combinée au TEP permet d’améliorer la caractérisation de l’hyperfixation de FDG. C’est en particulier dans le domaine de l’imagerie hépatique que le TEP/IRM pourrait s’imposer comme une référence. En effet, les études des dix dernières années ont montré que le TEP au FDG manquait de sensibilité pour la détection des métastases hépatiques, et ceci pour plusieurs raisons : résolution spatiale plus faible qu’en scanner ou en IRM, présence de mouvements respiratoires et digestifs entraînant un flou lésionnel, bruit de fond hépatique pouvant gêner l’individualisation de petites lésions, et faible métabolisme glucidique pour certains types histologiques tumoraux. Les systèmes de détection TEP plus récents, notamment grâce à la technologie de temps de vol et aux possibilités de modéliser la fonction de réponse du détecteur, permettent d’obtenir des images plus contrastées et mieux résolues. Ainsi, les performances des systèmes TEP modernes sont clairement améliorées, particulièrement en termes de sensibilité (Fig. 3a). De plus, la TEP au FDG offre une très bonne spécificité au niveau hépatique, ainsi qu’une bonne valeur prédictive positive. En effet, en dehors de contextes particuliers, tels que les abcès du foie ou les lésions post radiques ou en cas de certains adénomes inflammatoires, il existe peu de faux positifs hépatiques en oncologie digestive. Parallèlement, l’IRM hépatique moderne, incluant l’imagerie de diffusion et éventuellement les produits de contraste hépato spécifiques, constitue aujourd’hui l’examen le plus sensible pour la détection des lésions hépatiques. Cependant, certaines lésions de petite taille peuvent être difficiles à caractériser. Ainsi, l’imagerie simultanée TEP/IRM pourrait devenir un examen performant pour le bilan de lésions hépatiques en combinant la haute spécificité du TEP et la haute sensibilité de l’IRM, notamment en cas de bilan préopératoire (Figs 3b, 4a et 4b).
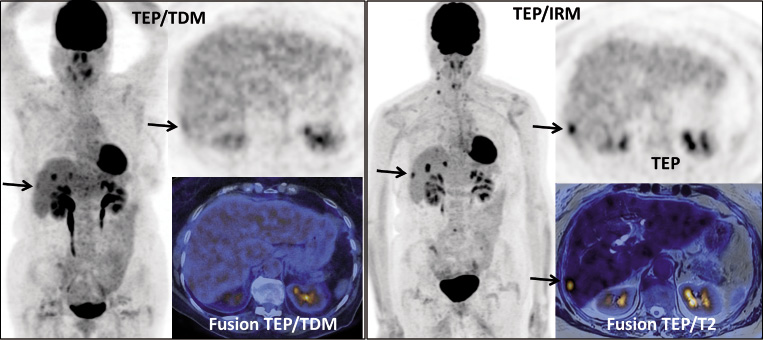
Figure 3a. Femme de 75 ans. Cancer colorectal (T3N1M0) traité par chirurgie et chimiothérapie. Bilan de récidive hépatique. Réalisation d’un TEP/TDM suivi d’un TEP/IRM. Le TEP/TDM montre plusieurs fixations hépatiques. Le TEP/IRM permet de préciser l’étendue de l’atteinte hépatique, en montrant clairement une lésion sous capsulaire du secteur postérieur du foie droit, très mal visualisée sur le TEP/TDM (flèche)

Figure 3b. Même patiente. Coupes transversales au niveau du dôme hépatique. Le TEP/TDM apparaît normal à ce niveau. Le TEP/IRM montre deux fixations focales de petite taille, dont le caractère pathologique est difficile à affirmer. Une séquence de diffusion montre clairement deux hypersignaux pathologiques en regard des deux hyperfixations. La confrontation du TEP et de la diffusion permet de renforcer la confiance dans le diagnostic de métastases hépatiques à ce niveau

Figure 4a. Femme de 62 ans. Bilan d’extension initial d’un carcinome séreux de l’ovaire. Le TEP/TDM montre des fixations en rapport avec une carcinose péritonéale pelvienne et du grand épiploon (flèches). Le TEP/IRM réalisé juste après le TEP/TDM montre des sites supplémentaires d’atteinte péritonéale, dans la région péri-hépatique et la gouttière pariéto-colique gauche (flèches)

Figure 4b. Même patiente. Coupes transversales au niveau du dôme hépatique. Le TEP/TDM ne montre pas d’anomalies à ce niveau. Le TEP/IRM montre clairement l’ascite et des fixations anormales sur la coupole diaphragmatique, bien visibles aussi sur les séquences de diffusion (flèches). L’excellent recalage entre TEP et IRM, du fait de l’acquisition simultanée et la concordance des anomalies, renforcent le degré de confiance diagnostique
D’autres situations diagnostiques pourraient aussi bénéficier de l’analyse combinée du TEP et de l’IRM comme l’étude de l’extension locorégionale des cancers du rectum, des cancers ORL et du col de l’utérus.
Amélioration de la quantification en TEP
L’acquisition simultanée d’examens TEP et IRM ouvre des opportunités prometteuses pour la quantification du signal TEP. L’acquisition des informations IRM devrait améliorer l’estimation de paramètres classiques en TEP, à partir d’examens statiques ou dynamiques.
Correction de mouvements respiratoires
Grâce à la très haute sensibilité des systèmes de détection TEP récents et la possibilité d’acquérir simultanément de l’IRM dynamique, l’utilisation de la synchronisation respiratoire en routine doit être repensée, étant jusqu’à maintenant sous utilisée car trop lourde à mettre en œuvre. En raison du temps relativement long nécessaire pour acquérir des données, les images TEP sont soumises aux effets du mouvement du patient. Les mouvements peuvent être périodiques, comme dans le cas des poumons ou du cœur, ou non périodiques comme dans le cas du péristaltisme du tractus gastro-intestinal, mais aussi en rapport avec les mouvements du patient pendant la durée de l’acquisition du TEP. Les conséquences de l’introduction de ce flou dans les images sont : premièrement, pour de petites lésions hyperfixantes, une diminution de l’activité apparente, et donc des erreurs d’estimation de l’activité métabolique des lésions ; deuxièmement, le risque que cette réduction d’activité rende les petites lésions indétectables du bruit du fond, conduisant ainsi à une baisse de la sensibilité de l’examen. Cet effet peut être particulièrement gênant pour l’imagerie hépatique, car le foie présente un bruit de fond relativement important, en comparaison avec celui du poumon, quasi nul.
Des dispositifs externes (ceintures pneumatiques, caméras optiques) peuvent être utilisés pour enregistrer le signal respiratoire et corriger les images du mouvement, mais les mouvements des organes internes ne peuvent pas être mesurés directement à l’aide de ces techniques. Des tentatives pour corriger le mouvement en utilisant les données TEP seules ne réussissent que dans les régions où la fixation du traceur est assez élevée pour obtenir suffisamment d’informations sur le mouvement.
Le TEP/IRM offre la possibilité d’acquérir des images IRM anatomiques de haute qualité en continu tout au long de l’acquisition du TEP avec une résolution temporelle élevée, et corrélées exactement spatialement et temporellement aux données d’émission du TEP. En TEP/TDM, une telle approche est difficile du fait des contraintes de radioprotection, et de la non-simultanéité des acquisitions TEP et TDM. L’utilisation des techniques de correction de mouvements en TEP/IRM permettra d’améliorer les performances des examens, notamment dans la cavité abdominale où le bruit de fond et les mouvements sont fréquents.
Pour en savoir plus. La correction de mouvement basée sur l’IRM comporte plusieurs étapes [27]. Premièrement, des protocoles d’acquisition d’IRM dédiés sont nécessaires pour l’acquisition d’images dynamiques suffisamment rapides au niveau d’un champ de vue déterminé. Deuxièmement, des champs de déformation décrivant les mouvements de chaque voxel (= élément de volume) au cours du cycle respiratoire sont extraits des données. Enfin, ces champs de déformation peuvent ensuite être incorporés dans un algorithme de reconstruction TEP, ou bien être appliqués sur des images TEP reconstruites, afin d’obtenir des images TEP corrigées du mouvement.
Une étude au CEA-SHFJ a montré l’intérêt d’utiliser en routine la synchronisation respiratoire avec ceinture pneumatique au cours de bilans oncologiques de routine [28, 29]. Chez des patients atteints de lésions pulmonaires, médiastinales ou hépatiques, en TEP, un tiers des lésions était significativement affecté par le flou respiratoire (flou perceptible visuellement). Au sein de ces lésions visuellement affectées par le mouvement respiratoire en TEP, la correction du mouvement respiratoire (méthode Q.Freeze, basée sur un recalage non rigide des phases du cycle), s’est avérée efficace dans la quasi-totalité des cas (97 %), conduisant à une disparition partielle ou complète du flou visuel, et à une augmentation significative du SUV (augmentation médiane du SUVpeak de 9,4 %) (Fig. 5). Les corrections de mouvement respiratoire peuvent donc avoir un impact sur la quantification et modifier en particulier la classification des réponses thérapeutiques en oncologie.
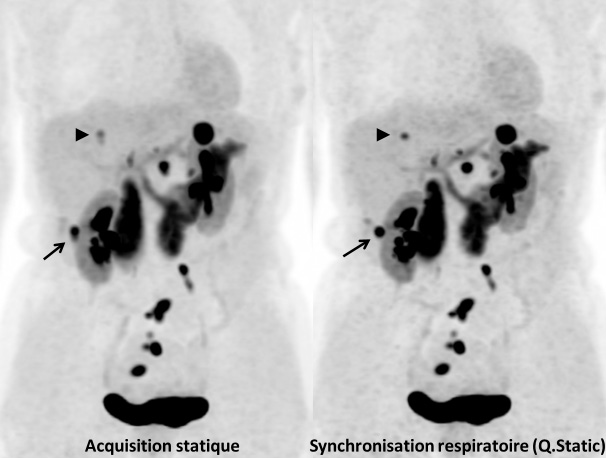
Figure 5. Tumeur neuro-endocrine différenciée du grêle. Bilan de réévaluation par TEP/IRM à la Fluoro-DOPA. Comparaison des acquisitions sans et avec synchronisation respiratoire. L’examen montre des lésions tumorales ganglionnaires pelviennes, ainsi que plusieurs lésions hépatiques. La lésion hépatique indiquée par une flèche apparaît plus nette sur l’image synchronisée, avec moins de flou. La lésion indiquée par une tête de flèche, nettement visible sur l’image synchronisée, apparaît presque comme deux lésions contiguës sur l’image non synchronisée. La synchronisation respiratoire a pour avantages de diminuer le flou dans les images, d’améliorer le recalage avec l’IRM, et d’améliorer la quantification de la fixation par le SUV
Vers des nouveaux biomarqueurs ?
Il est envisageable d’accéder à de nouveaux biomarqueurs, qui intègreront dans leur définition même les informations quantitatives de la TEP augmentées d’informations IRM. Étant donné la richesse potentielle du signal IRM, on peut envisager de créer de nouvelles images paramétriques qui intègrent du signal TEP et un type de signal IRM, afin de faire de l’imagerie TEP-IRM hybride une nouvelle modalité d’imagerie, donnant accès à des images allant au-delà de la simple superposition d’images TEP et IRM. En particulier, l’imagerie hybride simultanée TEP/IRM permettra d’étudier de manière non invasive, in vivo, les voies de signalisation moléculaire impliquées dans le développement tumoral. D’une part, l’imagerie moléculaire en TEP peut se baser sur l’utilisation de radiotraceurs spécifiques ciblant une voie de signalisation tumorale ou un récepteur, mais aussi de radiotraceurs non spécifiques de la physiopathologie tumorale comme les traceurs de l’hypoxie ou de l’angiogenèse. D’autre part, l’IRM permet de combiner des informations fonctionnelles (diffusion, perfusion) et des informations plus spécifiques grâce à la spectrométrie, qui dévoilent la composition de certaines molécules d’un tissu. De plus, la résolution spatiale et temporelle de l’IRM est supérieure à celle du TEP, et complète avantageusement la très haute sensibilité du TEP. En particulier, l’IRM du rehaussement dynamique de contraste offre des informations quant à la microvascularisation tumorale. Le compartiment cellulaire quant à lui pourra être apprécié à l’aide de séquences de diffusion. Ces paramètres biologiques issus de l’IRM, en plus d’informations sur une signalétique tumorale apportée par le radiotraceur, forment un ensemble complexe qui devrait permettre de mieux comprendre, voire de prédire l’efficacité des traitements, ainsi que les mécanismes de résistance en jeu.
Cette recherche de nouveaux biomarqueurs représente un défi plus ambitieux, mais susceptible d’apporter une vraie rupture de concept en imagerie hybride.
Conclusions
Le TEP/IRM est une technique innovante permettant de combiner les meilleurs systèmes TEP du marché à des IRM 3 T fonctionnant comme des IRM des services de radiologie. La combinaison des deux modalités permet une meilleure précision dans le diagnostic de maladie tumorale, notamment en diminuant les risques de faux positifs et faux négatifs de la TEP au FDG. Les bilans des cancers digestifs, et en particulier l’imagerie du foie et de la cavité péritonéale, bénéficieront certainement de la véritable synergie entre TEP et IRM, qui mènera à des examens plus précis et à une meilleure confiance dans le diagnostic. C’est aussi dans la recherche plus fondamentale et en particulier dans la recherche de nouveaux biomarqueurs d’imagerie que le TEP/IRM est susceptible d’apporter une vraie rupture de concept en imagerie hybride.
Le TEP/IRM représente incontestablement un investissement d’avenir permettant d’aller plus loin dans le bilan des maladies tumorales et dans l’amélioration de la prise en charge des patients, même si des efforts en termes de recherche clinique sont encore nécessaires pour positionner le TEP/IRM aux côtés des autres techniques que sont le TEP/TDM, le scanner et l’IRM.
Remerciements
Les travaux sur le TEP/IRM du CEA-SHFJ ont été soutenus par le programme PIM (Physics and Imaging for Medicine, ANR-11-IDEX-0003-02). La plateforme TEP/IRM a été acquise en majeure partie grâce à un financement de France Life Imaging (FLI). Mes remerciements vont aussi vers Badia Helal, Irène Buvat, et Claude Comtat pour leur rôle dans la mise en place de la plateforme et son bon fonctionnement.
Références
- Fendler WP, Czernin J, Herrmann K, Beyer T. Variations in PET/MRI operations : Results from an international survey among 39 active sites. J Nucl Med Off Publ Soc Nucl Med. 11 août 2016.
- Stefaan Vandenberghe and Paul K Marsden. PET-MRI : a review of challenges and solutions in the development of integrated multimodality imaging. Phys Med Biol. 2015 ;
60(4) :R115. - Levin CS, Jansen F, Deller T, Maramraju SH, Grant A, Iagaru A. Performance of a high sensitivity time-of-flight PET ring operating simultaneously within a 3T MR system. EJNMMI Phys. 2014 ;1(1) :A72.
- A. A. Wagadarikar, A. Ivan, S. Dolinsky, D. L. McDaniel. Sensitivity Improvement of Time-of-Flight (ToF) PET Detector Through Recovery of Compton Scattered Annihilation Photons. IEEE Trans Nucl Sci. févr 2014 ;
61(1) :121-5. - Stanisz GJ, Odrobina EE, Pun J, Escaravage M, Graham SJ, Bronskill MJ, et al. T1, T2 relaxation and magnetization transfer in tissue at 3T. Magn Reson Med. 2005 ;54(3) :507-12.
- Fraum TJ, Fowler KJ, McConathy J. Conspicuity of FDG-Avid Osseous Lesions on PET/MRI Versus PET/CT : a Quantitative and Visual Analysis. Nucl Med Mol Imaging. sept 2016 ;50(3) :228-39.
- Burris NS, Johnson KM, Larson PEZ, Hope MD, Nagle SK, Behr SC, et al. Detection of Small Pulmonary Nodules with Ultrashort Echo Time Sequences in Oncology Patients by Using a PET/MR System. Radiology. janv 2016 ;278(1) :239-46.
- Kusmirek J, Robbins J, Allen H, Barroilhet L, Anderson B, Sadowski EA. PET/CT and MRI in the imaging assessment of cervical cancer. Abdom Imaging. oct 2015 ;40(7) :2486-511.
- Salem S, Houseni M, Zidan L, Kandil A. The added value of PET/Ce-CT/DW-MRI fusion in assessment of hepatic focal lesions : PET/Ce-CT/DW-MRI fusion in hepatic focal lesion. Nucl Med Biol. juill 2015 ;42(7) :637-42.
- Soussan M, Des Guetz G, Barrau V, Aflalo-Hazan V, Pop G, Mehanna Z, et al. Comparison of FDG-PET/CT and MR with diffusion-weighted imaging for assessing peritoneal carcinomatosis from gastrointestinal malignancy. Eur Radiol. juill 2012 ;22(7) :1479-87.
- Czernin J, Ta L, Herrmann K. Does PET/MR Imaging Improve Cancer Assessments ? Literature Evidence from More Than 900 Patients. J Nucl Med Off Publ Soc Nucl Med. 8 mai 2014 ;55(Supplement 2) :59S-62S.
- Ohno Y, Koyama H, Yoshikawa T, Takenaka D, Seki S, Yui M, et al. Three-way Comparison of Whole-Body MR, Coregistered Whole-Body FDG PET/MR, and Integrated Whole-Body FDG PET/CT Imaging : TNM and Stage Assessment Capability for Non-Small Cell Lung Cancer Patients. Radiology. juin 2015 ;275(3) :849-61.
- Lee G, I H, Kim S-J, Jeong YJ, Kim IJ, Pak K, et al. Clinical implication of PET/MR imaging in preoperative esophageal cancer staging : comparison with PET/CT, endoscopic ultrasonography, and CT. J Nucl Med Off Publ Soc Nucl Med. août 2014 ;55(8) :1242-7.
- Catalano OA, Nicolai E, Rosen BR, Luongo A, Catalano M, Iannace C, et al. Comparison of CE-FDG-PET/CT with CE-FDG-PET/MR in the evaluation of osseous metastases in breast cancer patients. Br J Cancer. 28 avr 2015 ;
112(9) :1452-60. - Melsaether AN, Raad RA, Pujara AC, Ponzo FD, Pysarenko KM, Jhaveri K, et al. Comparison of Whole-Body (18)F FDG PET/MR Imaging and Whole-Body (18)F FDG PET/CT in Terms of Lesion Detection and Radiation Dose in Patients with Breast Cancer. Radiology. oct 2016 ;281(1) :193-202.
- Hope TA, Pampaloni MH, Nakakura E, VanBrocklin H, Slater J, Jivan S, et al. Simultaneous (68)Ga-DOTA-TOC PET/MRI with gadoxetate disodium in patients with neuroendocrine tumor. Abdom Imaging. août 2015 ;40(6) :1432-40.
- Catalano OA, Rosen BR, Sahani DV, Hahn PF, Guimaraes AR, Vangel MG, et al. Clinical impact of PET/MR imaging in patients with cancer undergoing same-day PET/CT : initial experience in 134 patients–a hypothesis-generating exploratory study. Radiology. déc 2013 ;269(3) :857-69.
- Paspulati RM, Gupta A. PET/MR Imaging in Cancers of the Gastrointestinal Tract. PET Clin. oct 2016 ;11(4) :403-23.
- Lee DH, Lee JM. Whole-body PET/MRI for colorectal cancer staging : Is it the way forward ? J Magn Reson Imaging JMRI. 27 juin 2016 ;
- Beiderwellen K, Geraldo L, Ruhlmann V, Heusch P, Gomez B, Nensa F, et al. Accuracy of [18F]FDG PET/MRI for the Detection of Liver Metastases. PloS One. 2015 ;10(9) :
e0137285. - Beiderwellen K, Gomez B, Buchbender C, Hartung V, Poeppel TD, Nensa F, et al. Depiction and characterization of liver lesions in whole body [(1)(8)F]-FDG PET/MRI. Eur J Radiol. nov 2013 ;82(11) :e669-675.
- Lee DH, Lee JM, Hur BY, Joo I, Yi N-J, Suh K-S, et al. Colorectal Cancer Liver Metastases : Diagnostic Performance and Prognostic Value of PET/MR Imaging. Radiology. 19 avr 2016 ;280(3) :782-92.
- Reiner CS, Stolzmann P, Husmann L, Burger IA, Hullner MW, Schaefer NG, et al. Protocol requirements and diagnostic value of PET/MR imaging for liver metastasis detection. Eur J Nucl Med Mol Imaging. avr 2014 ;
41(4) :649-58. - Joo I, Lee JM, Lee DH, Lee ES, Paeng JC, Lee SJ, et al. Preoperative Assessment of Pancreatic Cancer with FDG PET/MR Imaging versus FDG PET/CT plus Contrast-enhanced Multidetector CT : A Prospective Preliminary Study. Radiology. 24 août 2016 ;152798.
- Soussan M, Comtat C, Brulon V, Buvat I, Helal OB. Feasibility and results of a short whole-body PET/MR protocol for staging primary and secondary thoracic lesions from solid tumors. J Nucl Med. 1 mai 2016 ;57(supplement 2) :240-240.
- Schaarschmidt BM, Grueneisen J, Heusch P, Gomez B, Umutlu L, Ruhlmann V, et al. Does 18F-FDG PET/MRI reduce the number of indeterminate abdominal incidentalomas compared with 18F-FDG PET/CT ? Nucl Med Commun. juin 2015 ;36(6) :588-95.
- Ouyang J, Li Q, El Fakhri G. Magnetic Resonance-Based Motion Correction for Positron Emission Tomography Imaging. Semin Nucl Med. 43(1) :60-7.
- Soussan M, Comtat C, Brulon V, Helal O, Buvat I. Dual-modality respiratory triggering is feasible during a routine PET/MR protocol. J Nucl Med. 1 mai 2016 ;57(supplement 2) :
242-242. - EANM’16. Eur J Nucl Med Mol Imaging. 2016 ;43(1) :1-734.
Les Cinq points forts
- Le TEP/IRM est une modalité d’imagerie hybride, technologiquement mature, combinant un système de détection TEP à une IRM 3 Tesla.
- Les imageurs TEP des TEP/IRM intègrent un grand nombre d’avancées technologiques récentes (large angle solide, détecteurs à semi-conducteurs, temps de vol, algorithmes de reconstruction optimisés), aboutissant à une amélioration de la sensibilité, du contraste et de la résolution des images, et ainsi à des examens plus précis. La correction du mouvement respiratoire est possible pour des examens de routine, améliorant la netteté des images et la quantification du signal TEP.
- Le TEP/IRM offre la possibilité de réaliser des bilans oncologiques « tout en un », combinant un examen corps entier, associé à une ou plusieurs imageries IRM d’organes, l’ensemble durant environ 45 min. Un meilleur confort pour le patient, une interprétation facilitée pour le médecin, et une optimisation de la prise en charge médicale des patients sont possibles.
- En oncologie digestive, des améliorations des performances du TEP sont observées, notamment en diminuant les incertitudes diagnostiques, en diminuant les taux de faux positifs et de faux négatifs des fixations de FDG.
- C’est aussi dans la recherche plus fondamentale et en particulier, dans la recherche de nouveaux biomarqueurs d’imagerie, que le TEP/IRM est susceptible d’apporter une vraie rupture de concept en imagerie hybride.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION