Les nouveaux traitements ablatifs des tumeurs du foie
Objectifs pédagogiques
- Connaître les principes , les indications et les limites de l’ablation par radiofréquence
- Connaître les principes , les indications et les limites de la cryoablation
- Connaître les principes , les indications et les limites de l’ablation par micro-ondes
- Connaître les principes , les indications et les limites de l’électroporation
- Perspectives de la navigation et de la robotique
Conflits d’intérêt
Olivier Seror : consultant pour Celon, Olympus, Angiodynamics, General Electric et Bayer healthcare.
Mots-clés : ablation percutanée, radiofréquence multi-bipolaire, électroporation irréversible
Résumé
Plusieurs technologies d’ablation sont aujourd’hui disponibles. À l’exception de l’électroporation, toutes ces mé-
thodes sont thermiques. Elles induisent à l’échelon cellulaire et tissulaire des déstructurations irréversibles. Qu’elle soit thermique ou non, une ablation percutanée nécessite la mise en place d’applicateurs pour délivrer in situ de l’énergie. Certaines requièrent l’insertion de plusieurs applicateurs (radiofréquence multi-bipolaire, cryothérapie, électroporation) tandis que pour les autres, comme la radiofréquence monopolaire ou les micro-ondes, un seul est le plus souvent suffisant. Ces méthodes qui conceptuellement peuvent apparaître très proches sont en réalité assez différentes tant en ce qui concerne leur utilisation pratique que les résultats qu’elles permettent d’obtenir. La compréhension de ces différences est déterminante pour appréhender les avantages et les limites de chacune des techniques. Le dispositif d’ablation parfaitement polyvalent de fait n’existe pas. Le choix entre ces techniques dépend des objectifs thérapeutiques qui varient selon les spécificités de chaque situation clinique.
5 énergies possibles mais deux stratégies de déposition : ablations radiaires centrifuges ou convergentes centripètes
Pendant longtemps la destruction in situ d’une tumeur s’est réalisée suivant un schéma de couverture centrifuge [1]. L’applicateur inséré au centre des tumeurs délivre de l’énergie idéalement de façon isotropique vers la périphérie. La déperdition radiaire d’énergie doit être suffisamment faible pour qu’au-delà de la tumeur une marge d’ablation dite de « sécurité » soit obtenue, afin de prévenir le développement secondaire d’éventuels micros foyers tumoraux extra nodulaires (Fig. 1). Cette stratégie d’ablation radiaire centrifuge, héritée des techniques d’ablation chimique, est aujourd’hui encore la plus utilisée car la plus simple à mettre en œuvre. Elle est à la base des techniques comme la radiofréquence monopolaire, les micro-ondes, le laser et la cryothérapie (Tableau I). Avec les techniques radiaires centrifuges, le traitement des tumeurs de plus de 3 cm (1,5 cm en laser et cryothérapie) nécessite la réalisation d’ablations chevauchées en mode séquentiel par réimplantation de l’applicateur ou en mode simultané par insertion de plusieurs applicateurs (techniques multi-mono-applicateur comme presque toujours en illumination laser ou en cryothérapie et parfois en radiofréquence monopolaire ou en micro-ondes [2]. Quelle soient séquentielles ou simultanées, les ablations chevauchées obtenues avec les dispositifs radiaires centrifuges sont une sommation de plusieurs destructions élémentaires centrifuges indépendantes (Fig. 1). Si les applicateurs sont suffisamment proches (ce qui est indispensable pour aboutir à une destruction continue) un effet synergique additionnel est observé. La simplicité conceptuelle des ablations réalisées avec les techniques radiaires centrifuges constitue leur principal avantage. Ceci est particulièrement évident en ce qui concerne la radiofréquence monopolaire et les micro-ondes qui permettent de détruire avec un seul applicateur et donc en une seule ponction des tumeurs allant jusqu’à 3 cm de diamètre. Cela suppose néanmoins que les tumeurs traitées soient le plus possible sphériques et que le postulat de propagation isotropique de l’énergie soit vérifié. Ces deux conditions sont globalement observées pour les tumeurs de petites tailles (< 2.5 cm). Au-delà, de grands écarts à ce scénario idéal peuvent survenir en raison de l’hétérogénéité des propriétés tissulaires (production, conduction et déperdition d’énergie notamment secondaire aux variations spatiales et temporelles des conditions micro et macro circulatoire des flux sanguins). En outre, l’expansion omnidirectionnelle des zones d’ablation fait courir le risque de lésion collatérale, en cas de tentative de traitement de tumeurs situées à proximité de structures nobles.
Tableau I. Caractéristiques des techniques ablatives des tumeurs du foie
| Stratégie du dépôt d’énergie | Technique | Thermique | N applicateurs | Avantages | Inconvénients | Indications |
|---|---|---|---|---|---|---|
| Radiaires centrifuges | RF monop (avec plaque de dispersion) | Oui | 1 à 3 | – Simplicité – Recule – Robustesse |
– Limitée en taille d’ablation | – ≤ 3 tumeurs nodulaires ≤ à 3 cm |
| Micro-ondes | Oui | 1 à 3 | – Simplicité – Rapidité – Repousse la limite de taille d’ablation un peu au-delà des 3 cm |
– Faible reproductibilité – Large calibre des applicateurs – Brûlure par rétrodiffusion de la chaleur |
– ≤ 5 tumeurs nodulaires ≤ à 3 cm – 1 tumeur nodulaire > 3 cm mais ≤ à 5 cm |
|
| Laser | Oui | 2 à > 6 | – Compatible avec l’IRM | – Multiplication du nombre de ponctions | – ≤ 3 tumeurs nodulaires ≤ à 3 cm – 1 tumeur nodulaire > 3 cm mais ≤ à 5 cm |
|
| Cryothérapie | Oui | 2 à > 6 | – Visibilité en temps réel de la formation du glaçon sous TDM (et toutes les autres modalités) – Compatible avec l’IRM |
– Multiplication du nombre de ponctions – Lenteur du process d’ablation – Pas de méthode simple pour réaliser l’ablation du trajet de ponction |
– ≤ 3 tumeurs nodulaires ≤ à 3 cm – 1 tumeur nodulaire > 3 cm mais ≤ à 5 cm – Tumeur en situation critique près de structures nobles |
|
| Centripètes Convergentes | RF multibipol. (sans plaque de dispersion) | Oui | 2 à 6 | – Prédictibilité de la forme et de la taille des zones d’ablation – Permet de réaliser des ablations no touch pour les tumeurs nodulaires ≤ 4 cm – Repousse les limites d’ablation au-delà des 5 cm (~ 8 cm) – Permet des destructions segmentaires incluant des invasions portales ≤ Vp2 – Permet en technique no touch de traiter avec une plus grande sécurité les tumeurs sous capsulaires |
– Multiplication du nombre de ponctions – Impose une sélection plus rigoureuse des patients concernant leur fonction hépatique (marge de sécurité plus importantes => amputation plus importante de parenchyme hépatique fonctionnel |
– ≤ 3 tumeurs nodulaires – ≤ à 3 cm (no touch) – 1 tumeur nodulaire > 3 cm mais ≤ à 4 cm (no touch) – 1 tumeur mass forming > 5 cm – ≤ 8 cm – Tumeur infiltrante envahissant jusqu’à deux segments avec – ± envahissement portal ≤ Vp2 |
| Electroporation irréversible | Non | 2 à 6 | – Idem que la radiofréquence multibipolaire avec cependant une capacité volumique de destruction moindre (≤ 6 cm) – Peut traiter des lésions en situation critique périphérique ou centrale incluant les invasions portales Vp3 – À volume d’ablation équivalent semble mieux tolérée que les thermo-ablations chez les patients fragiles et/ou insuffisants hépatocellulaires |
– Multiplication du nombre de ponctions – Lenteur du process d’ablation – Nécessité d’une anesthésie générale lourde avec curarisation profonde – Contre indiquée chez les patients avec pacemaker ou présentant une TACFA non appareillées > 100 b/m |
– ≤ 3 tumeurs nodulaires – ≤ à 2.5 cm (no touch) – Tumeur infiltrante – (≤ 6 cm de grand axe) avec – ± envahissement portal ≤ Vp3 – Tumeur en situation critique centrale ou périphériques (≤ 5 cm) – Patients fragiles insuffisants hépatocellulaires présentant – 1 tumeur ≤ 3 cm |
Une autre stratégie d’ablation consiste à faire converger l’énergie de la périphérie vers le centre de la tumeur (Fig. 1). Au minimum, deux applicateurs sont insérés en périphérie de la tumeur afin de déposer l’énergie de façon concentrique au sein de la cible. Actuellement, seules la radiofréquence et l’électroporation qui délivrent un courant RF en mode bipolaire permettent d’appliquer de façon satisfaisante cette stratégie (Tableau I). La continuité des zones de traitement est conditionnée par la distance entre les paires d’électrodes adjacentes. Trois cm en radiofréquence et 2,5 cm en électroporation sont les distances au-delà desquelles le risque de discontinuité des zones d’ablation devient important. Pour des raisons d’optimisation de délivrance de la dose dans l’espace, les cibles mesurant plus de deux centimètres de diamètre doivent impérativement être appréhendées comme des objets tridimensionnels (modélisable sous forme de sphère ou d’ellipse). Avec un système d’ablation radiaire con-vergent centripète, il est donc de règle d’utiliser au moins trois applicateurs implantés en configuration triangulaire (circonscrivant la tumeur) pour déposer l’énergie dans les trois plans de l’espace et s’assurer ainsi de « couvrir » entièrement la tumeur ainsi que son environnement immédiat (marges d’ablation) (Fig. 1). Au-delà de 3 cm de diamètre, quatre à six applicateurs et parfois plus seront rapidement nécessaires pour réaliser l’ablation d’un seul tenant de la tumeur et de la marge (5 mm minimum). Le dépôt d’énergie se fait toujours en mode bipolaire mais de façon séquentielle entre chaque couple d’électrode (techniques multibipolaires à différentier des techniques multi-monopolaire en radiofréquence monopolaire multi-applicateurs, ex : dispositifs à électrode déployable ou multiples indépendantes linéaires) (Fig. 1). En mode multi-bipolaire, quel que soit le nombre d’électrodes utilisées, celles-ci doivent être implantées préférentiellement en périphérie des cibles et non plus au centre. Mieux encore si la tumeur est suffisamment petite, il est recommandé de les implanter en dehors conformément au principe de l’ablation « no touch » [3]. Le principal intérêt des techniques d’ablation convergentes centripètes multi-bipolaires est en effet d’assurer de façon prédictible et sûre la destruction d’une marge de sécurité continue pour des tumeurs allant jusqu’à 4 cm de diamètre. En outre elles offrent la possibilité d’adapter la forme de la zone d’ablation à celle de la tumeur tout en tenant compte de sa situation (Fig. 2). L’ablation des lésions infiltrantes avec invasion portale non tronculaire est possible avec ces techniques. Le prix à payer est la plus grande complexité du geste qui nécessite l’implantation de plusieurs électrodes dans des directions et à des distances contrôlées.

Figure 1. Stratégies de déposition in situ d’énergie pour l’ablation des tumeurs
A. Ablation radiaire centrifuge mono-applicateur d’une tumeur. Le gradient d’énergie est décroissant du centre vers la périphérie (la marge).
B. Ablation radiaire centrifuge isotropique avec le même système qu’en A d’une tumeur d’un diamètre 1,6 fois supérieur. Six insertions d’applicateurs seraient théoriquement nécessaires si le volume de destruction final devait résulter de la sommation des zones d’ablation induites par chaque applicateur.
C. Ablation convergente centripète de la même tumeur qu’en A (radiofréquence multibipolaire ou electroporation irréversible). Trois électrodes sont insérées en périphérie de la tumeur en configuration triangulaire, idéalement en dehors si elle est assez petite (technique no touch). Chaque paire est activée séquentiellement deux à deux. L’intensité des champs électromagnétiques est maximale en périphérie de la tumeur (dans ou à proximité de la marge) tandis qu’au centre elle est certes atténuée mais l’énergie s’accumule par chevauchement.
D. La même tumeur qu’en B est traitée par ablation convergente centripète. L’implantation de six électrodes est nécessaire. Cinq sont insérées en configuration pentagonale en périphérie tandis que la sixième est insérée au centre de la tumeur. D’autres schémas d’implantation peuvent être proposés pour s’adapter aux contraintes de certaines localisations ou formes tumorales. Les ablations convergentes centripètes permettent d’augmenter les volumes tumoraux traités tout en modelant et contrôlant les limites d’ablation.

Figure 2. Ablation radiofréquence multibipolaire d’un CHC infiltrant du foie droit s’accompagnant d’une invasion postale Vp2
A. IRM axiale au temps artériel de l’injection de gadolinium montrant une tumeur mal limitée à cheval sur les segments 8 et 5. Il existe une invasion de la branche portale sectorielle antérieure droite (flèche).
B. Même coupe qu’en A sur laquelle le planning du positionnement des six électrodes est figuré (elles ne seront pas toutes positionnées dans le même plan. Les électrodes hors plan sont figurées en transparence). La stratégie du positionnement consiste à « couvrir » le secteur infiltré en positionnant les électrodes selon le grand axe de l’axe portal envahi.
C. Tomodensitométrie de contrôle un mois après au temps artériel de l’injection intraveineuse de produit de contraste iodée. La zone d’ablation a bien la forme pyramidale souhaitée avec pour sommet l’axe portale envahi et pour base le plan capsulaire des segments 8 et 5.
Le choix entre une approche radiaire centrifuge ou une technique convergente centripète dépend de plusieurs facteurs cliniques (Tableau I). Quand plusieurs cibles de petites tailles doivent être traitées simultanément (atteintes oligo-multi-nodulaires) et/ou de façon rapprochée dans le temps (formes multicentriques récidivantes), la simplicité et la rapidité des techniques ablatives centrifuges classiques apparaissent comme des atouts essentiels. La multiplication des sites d’ablations (en une ou plusieurs procédures) impose en effet une modération en termes de marge de sécurité. En revanche, en cas de lésion unique qui plus est volumineuse (> 3 cm), les techniques convergentes centripètes sont particulièrement attractives dans la mesure où l’obtention de marges de sécurité suffisantes augmente les chances de guérison (Fig. 3). Les localisations tumorales à risque de dommage collatéral ou de formes complexes (limites difficiles à identifier en imagerie) incitent également à utiliser en priorité les techniques convergentes centripètes qui offrent plus de possibilité de s’adapter à la zone d’ablation et à son environnement (Fig. 2).

Figure 3. Ablation radiofréquence multibipolaire d’un volumineux CHC de 5,5 cm (mass forming) du dôme hépatique
A. TDM axiale,
B. et frontale au temps artériel de l’injection intraveineuse de produit de contraste iodée montrant une masse du segments 8. Le planning du positionnement des six électrodes est figuré par des overlays (en section en A du fait de la trajectoire ascendante des électrodes). Noter que 5 électrodes sont positionnées en dehors autour de la masse et qu’une seule est insérée au centre afin d’assurer la continuité de l’ablation (technique convergente centripète. Voire aussi la Figure 1)
C. Tomodensitométrie de contrôle un mois après au temps artériel de l’injection intraveineuse de produit de contraste iodé. La zone d’ablation englobe parfaitement l’ancienne masse du segments 8 (compte tenu de la proximité du diaphragme une ascite artificielle de protection avait été créée avant le dépôt d’énergie).
Ablations radiaires centrifuges : radiofréquence monopolaire ou microondes ?
La capacité destructive de la radiofréquence comparée à celle des micro-
ondes pourrait être moindre car avec cette technique les températures atteintes ne peuvent dépasser 100°C tandis que plus de 150° C sont régulièrement atteintes en micro-ondes [4]. Les pics de température sont en outre atteints plus rapidement en micro-ondes qu’en radiofréquence. Ces mesures ont été cependant réalisées in vitro à quelques millimètres des applicateurs. Il est par conséquent prématuré de conclure à une supériorité clinique des micro-ondes. De fait, la supériorité théorique des micro-ondes ne s’est pas traduite à ce jour par des résultats sensiblement différents de ceux déjà rapportés avec la radiofréquence : le diamètre tumoral supérieur à 3 cm et la proximité de gros vaisseaux demeurent des facteurs prédictifs de traitement incomplet [5]. Une meta-analyse récente comparant les deux techniques conclut à une supériorité des micro-ondes en terme de contrôle local des métastases hépatiques colorectales dont le diamètre était compris entre 3 et 5 cm [6]. Ces résultats doivent être cependant considérés avec prudence compte tenu de l’hétérogénéité des pratiques et des performances des dispositifs utilisés en RF comme en micro-ondes [7].
La cryoablation : une technique de thermoablation radiaire centrifuge présentant l’atout de la visibilité temps réel de la formation du glaçon
Voir pendant la procédure de façon précise l’expansion de la zone d’ablation est un atout considérable pour l’efficacité et la sécurité des procédures. La cryothérapie présente de ce point de vue un avantage certain sur les autres méthodes ablatives, car les limites de la congélation des tissus est très bien visible avec l’ensemble des techniques d’imagerie en coupe notamment en tomodensitométrie, qui est une technique d’imagerie régulièrement utilisée quand le guidage échographique est jugé insuffisant. Avec cette technique, il est donc facile de monitorer de façon assez précise la progression du traitement sans avoir recours à l’injection de produit de contraste. Cela améliore indéniablement la sécurité des gestes, notamment lorsque les lésions sont localisées dans des secteurs anatomiques à haut risque de dommages collatéraux [8].
Ablations radiaires centrifuges combinées à l’embolisation artérielle
La combinaison d’une chimio-embolisation (le plus souvent première) avec une technique d’ablation, principalement la RF monopolaire, est préconisée de longue date par de nombreuses équipes pour améliorer le taux de contrôle local complet des petits CHC (< 5 cm). Il existe en effet un rationnel à associer ces deux traitements dans la mesure où les modifications perfusionelles induites par l’une ou l’autre potentialisent la seconde. Cependant, le bénéfice clinique réel de ces associations fait encore débat, même si une récente méta-analyse conclut à un meilleur contrôle local des CHC mesurant entre 3 et 5 cm avec la combinaison chimio-embolisation et radiofréquence monopolaire [9]. Le rem-
placement de la radiofréquence monopolaire par les micro-ondes n’a pas à ce jour démontré de supériorité pour ce type de traitement combiné [1].
L’alcoolisation associée au cours du même geste à une thermoablation par radiofréquence monopolaire ou par micro-ondes est utilisée par certaines équipes. Les principales publications concernant cette approche ont été rassemblées dans une méta-analyse comparative avec la radiofréquence monopolaire seule [1]. Le contrôle local des CHC était significativement meilleur quand une alcoolisation précédait l’ablathermie.
RF monopolaire intratumoral (radiaire centrifuge) versus RF multi-bipolaire no touch (convergente centripète)
L’analyse rétrospective de notre cohorte de patients traités par RF multi-bipolaire no touch pour CHC dans Milan sur cirrhose a mis en exergue un taux de récidive locale (échec de l’ablation du nodule) extrêmement bas (< 4 %) comparé à ceux communément rapportés après RF monopolaire intratumoral classique [3]. Ce résultat confirme l’excellent contrôle local constaté histologiquement sur explant de patients radiofréquencés par la technique multi-bipolaire no touch versus monopolaire intratumoral chez des patients transplantés pour CHC dans Milan [12]. Très récemment, la supériorité de la RF multi-bipolaire no touch sur la radiofréquence monopolaire intratumorale pour le traitement des nodules de CHC < 5 cm a été retrouvée dans une large étude rétrospective multicentrique française dans laquelle les deux bras comparatifs étaient parfaitement appariés [13]. En outre la radiofréquence multi-bipolaire est la technique qui permet les ablations hépatiques contrôlées les plus larges. Avec la radiofréquence multi-bipolaire, il est possible de traiter des tumeurs « mass forming » > 5 cm (jusqu’à 8 cm) (Fig. 3) ainsi que les lésions infiltrantes sans ou avec invasion portale (jusqu’aux branches Vp2) (Fig. 2) [14].
L’électroporation : technique convergente centripète non thermique
L’électroporation est la seule technique physique d’ablation non thermique. Des dizaines de pulses RF de quelques µs à très haute intensité (20-50A jusqu’à 5000 V) délivrés entre deux électrodes (mode bipolaire) provoquent des altérations irréversibles des fonctions membranaires des cellules soumises aux champs électromagnétiques pulsés [15]. La mort cellulaire est soit immédiate par nécrose de coagulation, soit retardée par apoptose. Les structures de soutien telles que les fibres conjonctives, les membranes basales ainsi que les lumières des vaisseaux et des canalicules des tissus non tumoraux sont en revanche relativement bien respectées. Les cellules immunocompétentes et les macrophages peuvent parvenir au cœur des zones électroporées. Ceci explique leur tendance à la rétraction rapide au cours de la surveillance. L’architecture conjonctive étant globalement conservée, une recolonisation de proche en proche par la division des cellules saines situées à la marge de la zone de traitement est possible. Ce scénario d’ablation « douce » permet d’envisager le traitement de tumeurs considérées jusqu’ici comme contre-indiquées avec les autres méthodes thermiques, soit du fait de leur localisation jugée dangereuse (ex : tumeur hilaire…), soit du fait de la fragilité des patients (fonction d’organe précaire, comorbidités…) (Fig. 4). De fait, peu de lésions collatérales sévères ont été observées à ce jour chez des patients traités par électroporation en raison d’une localisation tumorale contre-indiquant les ablathermies [16, 17]. L’électroporation fonctionnant nécessairement en mode bipolaire, deux électrodes au minimum doivent être insérées à 2,5 cm de distance maximale. Les limites de la zone de traitement efficace correspondent approximativement à celles du champ électromagnétique de haute intensité (> 600V /cm) créé entre les deux électrodes. L’électroporation est donc une technique multi-bipolaire convergente centripète (Fig. 1) (Tableau I). Comme la radiofréquence multi-bipolaire, elle permet de modeler la zone d’ablation en fonction de la localisation et de la forme tumorale. Elle est en mesure de traiter des lésions infiltrantes s’accompagnant d’une extension portale jusqu’au branche Vp3 du fait de son innocuité relative pour les éléments nobles du pédicule hépatique (VBP et convergence) (Fig. 4). Les volumes d’ablation sont cependant plus modestes qu’en radiofréquence multibipolaire (en règle 6 cm avec six électrodes).

Figure 4. Ablation par electroporation irréversible d’un CHC infiltrant du foie droit avec envahissement portale Vp3
A. IRM axiale au temps artériel de l’injection intraveineuse de gadolinium montrant une tumeur mal limitée du foie droit responsable d’un envahissement de la branche portale droite (Vp3) ainsi que des branches sectorielles antérieur et postérieur (flèche).
B. IRM axiale au temps artériel de l’injection intraveineuse de gadolinium réalisée un mois après une ablation par électroporation avec six aiguilles (implantations par abord latéral selon l’axe de branche portale droite. Cf : figure 2) montrant une excellente réponse avec la disparition de la prise de contraste du thrombus tumorale.
C. Même coupe IRM qu’en B au temps portale de l’injection montrant la perméabilité conservée de la branche portale gauche et l’absence de dommage de la convergence biliaire principale bien que l’ablation ait été réalisée au contact de ces éléments nobles.
L’utilisation de pulses RF de haute intensité peut induire des myoclonies. L’anesthésie générale avec curarisation profonde est donc indispensable. Par ailleurs la délivrance des pulses en dehors de la période réfractaire du myocarde (segment ST de l’ECG) peut entraîner des arythmies sévères. Le dépôt d’énergie est donc obligatoirement synchronisé à l’ECG. L’electro-
poration est contre-indiquée chez les patients porteurs d’un pace maker cardiaque ou ayant une TACFA non appareillée > 100 b/m.
Multiplication des applicateurs : le nouveau paradigme des complications post ablation
Le taux de succès des traitements mono-applicateurs radiaires centrifuges se dégrade très rapidement dès lors que la tumeur traitée est supérieure à 3 cm (Fig. 1). Ceci explique la tendance actuelle à l’augmentation du nombre d’applicateurs utilisés par procédure. Augmenter le nombre de ponctions pour obtenir des volumes d’ablation plus importants a nécessairement un impact sur les risques de complications. Il existe en effet une relation claire entre le risque hémorragique, le nombre de passages et le calibre des aiguilles utilisées. De fait, l’hémorragie fait bien partie des principales complications des gestes d’ablation percutanée hépatique. Cependant, les dommages collatéraux et l’abcédassion des zones d’ablation sont des complications tout aussi fréquentes. Leurs issues sont souvent bien plus graves. Elles sont reliées au volume de nécrose dont l’extension est insuffisamment maîtrisée et non au nombre ou au calibre des applicateurs utilisés. Plusieurs artifices comme le refroidissement, l’hydro ou la gazo-dissection des structures nobles de voisinage ont été proposés pour réduire les risques de dommages collatéraux [18]. Rappelons cependant qu’à volume d’ablation équivalent ou même supérieur, le risque de dommage collatéral n’est pas le même selon que l’on utilise une technique convergente centripète comme la radiofréquence multi-bipolaire ou une technique multi-applicateurs radiaires centrifuges comme la radiofréquence monopolaire (Fig. 1). Avec la première on maîtrise bien plus facilement les limites de destruction, ce qui permet un certain « modelage » des zones d’ablation en fonction de la forme et de la localisation des tumeurs (Fig. 2, 3) [14]. En revanche, compte tenu du sacrifice plus important de parenchyme hépatique non tumoral avec la radiofréquence multibipolaire, notamment en technique no touch, cette méthode doit être utilisée avec discernement chez les patients cirrhotiques [13]. Elle est ainsi proscrite chez les patients Child-Pugh B. L’electro-poration qui est une technique convergente centripète partage avec la radiofréquence multibipolaire l’avantage d’une bien meilleure prédictibilité des limites d’ablation. À cela s’ajoute qu’il ne s’agit pas d’une thermoablation. Elle est donc tout particulièrement adaptée au traitement des tumeurs hépatiques de localisation dangereuse (Fig. 4). L’electroporation a en outre un effet beaucoup moins délétère sur le parenchyme hépatique non tumoral que les thermoablations. Les risques de décompensation hépatique post electroporation sont donc certainement moindres qu’après destruction thermique [19]. Comme le risque hémorragique, le risque d’ensemencement des trajets de ponction est relié au nombre de ponctions réalisées. La technique no touch (possible pour les tumeurs de petites tailles avec les techniques convergentes centripètes) élimine pratiquement tout risque d’ensemencement y compris pour les localisations superficielles. Les techniques ablatives permettant de réaliser une thermo-coagulation des trajets de ponction comme la radiofréquence et les micro-ondes réduisent à la fois les risques d’ensemencement et d’hémorragie. Avec les autres techniques comme l’illumination laser, la cryothérapie et l’électroporation, ces deux risques sont théoriquement plus importants. Les électrodes d’électroporation particulièrement fines (19G) expliquent cependant certainement le faible nombre d’accidents hémorragiques rapportés avec cette technique en dépit d’un nombre relativement important de ponctions réalisées au cours des procédures.
Au total, le nombre et le calibre des applicateurs utilisés ne semblent pas impacter de façon déterminante le risque de complication des ablations réalisées par voie percutanée. La sécurité des gestes d’ablation impliquant plusieurs ponctions a aussi certainement bénéficié d’une élévation globale du niveau d’expertise des opérateurs sans oublier l’apport déterminant des améliorations et des avancées réalisées dans le domaine de l’imagerie de guidage et de la fusion multimodale (Fig. 5) [20].
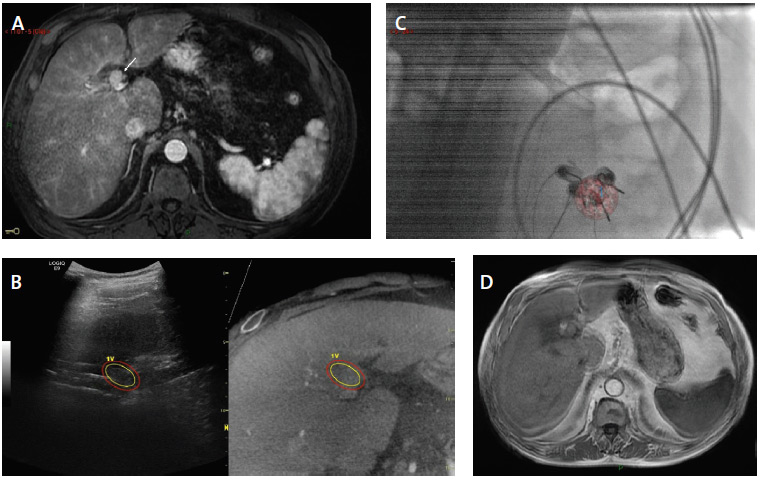
Figure 5. Ablation par electroporation irréversible par guidage multimodale fusionné d’un CHC nodulaire de 2 cm à développement préhilaire.
A. IRM axiale au temps artériel de l’injection intraveineuse de gadolinium montrant une tumeur nodule hypervasculaire du segment 4 (flèche) venant en contact de la voie biliaire principale
B. Synchronisation de l’acquisition 3D RX cone beam CT pré ablative avec l’échographie permettant de renforcer la visualisation échographique de la tumeur en propageant un contourage 3D de la tumeur réalisé à partir des images cone beam CT synchronisées.
C. Visualisation en fluoroscopie de l’agencement de quatre électrodes par rapport à la superposition de l’image segmentée de la tumeur à partir des coupes cone beam CT. Noter la visualisation bull eyes des quatre électrodes implantées en périphérie du nodule, permise par la rotation de l’arceau.
D. L’IRM de contrôle un mois après, au temps artériel de l’injection intraveineuse de produit de contraste gadoliné montre un centrage parfait de la zone d’ablation par rapport au nodule qui présente un aspect de réponse complète comme en atteste la disparition de la prise de contraste.
Conclusion
À l’instar du bistouri en chirurgie, la technique d’ablation universelle en radiologie interventionnelle n’existe pas. Les avantages d’une méthode donnée sont souvent consubstantiels de ses limites. De fait chaque technique peut offrir dans une situation clinique particulière le meilleur rapport bénéfice/risque. C’est pourquoi il est important de connaître les principes fondamentaux et les caractéristiques des nouvelles méthodes ablatives qui élargissent considérablement le champ des indications du traitement percutané des tumeurs malignes hépatiques. L’enjeu est d’offrir à plus de patients l’accès aux traitements curatifs.
Références
- Seror O. Percutaneous hepatic ablation: what needs to be known in 2014. Diagn Interv Imaging. 2014;95(7-8):665-75.
- Dodd GD, 3rd, Frank MS, Aribandi M, Chopra S, Chintapalli KN. Radiofrequency thermal ablation: computer analysis of the size of the thermal injury created by overlapping ablations. AJR American journal of roentgenology. 2001;177(4):777-82.
- Seror O, N’Kontchou G, Nault JC, Rabahi Y, Nahon P, Ganne-Carrie N, et al. Hepatocellular Carcinoma within Milan Criteria: No-Touch Multibipolar Radiofrequency Ablation for Treatment-Long-term Results. Radiology. 2016;280(3):981.
- Simon CJ, Dupuy DE, Mayo-Smith WW. Microwave ablation: principles and applications. Radiographics. 2005;25 Suppl 1:S69-83.
- Vogl TJ, Farshid P, Naguib NN, Darvishi A, Bazrafshan B, Mbalisike E, et al. Thermal ablation of liver metastases from colorectal cancer: radiofrequency, microwave and laser ablation therapies. Radiol Med. 2014;
119(7):451-61. - Correa-Gallego C, Fong Y, Gonen M, D’Angelica MI, Allen PJ, DeMatteo RP, et al. A retrospective comparison of microwave ablation vs. radiofrequency ablation for colorectal cancer hepatic metastases. Ann Surg Oncol. 2014;21(13):4278-83.
- Hoffmann R, Rempp H, Erhard L, Blumenstock G, Pereira PL, Claussen CD, et al. Comparison of four microwave ablation devices: an experimental study in ex vivo bovine liver. Radiology. 2013;268(1):89-97.
- Zargar H, Atwell TD, Cadeddu JA, de la Rosette JJ, Janetschek G, Kaouk JH, et al. Cryoablation for Small Renal Masses: Selection Criteria, Complications, and Functional and Oncologic Results. Eur Urol. 2015.
- Chen QW, Ying HF, Gao S, Shen YH, Meng ZQ, Chen H, et al. Radiofrequency ablation plus chemoembolization versus radiofrequency ablation alone for hepatocellular carcinoma: A systematic review and meta-analysis. Clin Res Hepatol Gastroenterol. 2016;40(3):309-14.
- Vasnani R, Ginsburg M, Ahmed O, Doshi T, Hart J, Te H, et al. Radiofrequency and microwave ablation in combination with transarterial chemoembolization induce equivalent histopathologic coagulation necrosis in hepatocellular carcinoma patients bridged to liver transplantation. Hepatobiliary Surg Nutr. 2016;5(3):225-33.
- Li Z, Zhang K, Lin SM, Mi DH, Cao N, Wen ZZ, et al. Radiofrequency ablation combined with percutaneous ethanol injection for hepatocellular carcinoma: a systematic review and meta-analysis. Int J Hyperthermia. 2016:1-10.
- Seror O, N’Kontchou G, Van Nhieu JT, Rabahi Y, Nahon P, Laurent A, et al. Histopathologic comparison of monopolar versus no-touch multipolar radiofrequency ablation to treat hepatocellular carcinoma within Milan criteria. Journal of vascular and interventional radiology : JVIR. 2014;25(4):599-607.
- Hocquelet A, Aube C, Rode A, Cartier V, Sutter O, Manichon AF, et al. Comparison of no-touch multi-bipolar vs. monopolar radiofrequency ablation for small HCC. J Hepatol. 2016.
- Seror O, N’Kontchou G, Ibraheem M, Ajavon Y, Barrucand C, Ganne N, et al. Large (>or=5.0-cm) HCCs: multipolar RF ablation with three internally cooled bipolar electrodes–initial experience in 26 patients. Radiology. 2008;248(1):288-96.
- Silk M, Tahour D, Srimathveeravalli G, Solomon SB, Thornton RH. The state of irreversible electroporation in interventional oncology. Semin Intervent Radiol. 2014;31(2):111-7.
- Narayanan G, Bhatia S, Echenique A, Suthar R, Barbery K, Yrizarry J. Vessel patency post irreversible electroporation. Cardiovasc Intervent Radiol. 2014;37(6):1523-9.
- Scheffer HJ, Melenhorst MC, van Tilborg AA, Nielsen K, van Nieuwkerk KM, de Vries RA, et al. Percutaneous Irreversible Electroporation of a Large Centrally Located Hepatocellular Adenoma in a Woman with a Pregnancy Wish. Cardiovasc Intervent Radiol. 2014.
- Kondo Y, Yoshida H, Shiina S, Tateishi R, Teratani T, Omata M. Artificial ascites technique for percutaneous radiofrequency ablation of liver cancer adjacent to the gastrointestinal tract. Br J Surg. 2006;
93(10):1277-82. - Bhutiani N, Philips P, Scoggins CR, McMasters KM, Potts MH, Martin RC. Evaluation of tolerability and efficacy of irreversible electroporation (IRE) in treatment of Child-Pugh B (7/8) hepatocellular carcinoma (HCC). HPB (Oxford). 2016;18(7):593-9.
- Minami Y, Kudo M. Ultrasound fusion imaging of hepatocellular carcinoma: a review of current evidence. Dig Dis. 2014;32(6):
690-5.
Les Cinq points forts
- Plusieurs méthodes ablatives sont disponibles. Aucune n’est universelle et le choix est orienté par la situation clinique du patient.
- Les techniques d’ablations se subdivisent en deux catégories : les techniques à dépôt d’énergie radiaire centrifuge et les techniques à dépôt d’énergie convergent centripète.
- Les techniques convergentes centripètes ont une bien meilleure prédictibilité des zones d’ablations. Elles permettent en conséquence de mieux s’adapter à la forme et à la localisation des tumeurs à traiter.
- Comparée à la radiofréquence monopolaire intratumorale classique (radiaire centrifuge), la technique de radiofréquence multibipolaire no touch (convergente centripète) augmente significativement le taux de réponse complète des CHC dans les critères de Milan.
- L’électroporation est une technique à dépôt d’énergie convergent centripète non thermique. Elle offre la possibilité de traiter des tumeurs (nodulaires ou infiltrantes avec ou sans invasion portale) à risque trop élevé de complication avec les techniques de thermoablation.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION