Dysplasie anale du VIH
Objectifs pédagogiques
- Epidémiologie et enjeux de dépistage
- Sémiologie lésionnelle
- Stratégie de prise en charge
Terminologie et définitions
Les lésions de dysplasie anale sont des lésions de l’épithélium malpighien ou transitionnel du canal anal secondaires à une infection persistante par un papilloma virus humain (HPV), dont certaines vont progresser vers le cancer épidermoïde du canal anal. Le terme de dysplasie reste largement utilisé malgré l’absence de terminologie et de classification consensuelles. Le terme de néoplasie intra-épithéliale AIN (anal intraepithelial neoplasia) lui est souvent préféré car il reflète mieux la réalité des lésions. Il s’agit en effet par définition de lésions strictement intra-épithéliales, c’est-à-dire limitées à l’épithélium et respectant l’intégrité de la membrane basale. Selon la sévérité des atypies cellulaires, la hauteur de l’infiltration de l’épiderme (tiers profond, deux tiers profonds ou totalité) par ces cellules anormales et la sévérité de la désorganisation architecturale, une classification en trois grades (léger, modéré et sévère) a été proposée. Devant sa mauvaise reproductibilité, une classification en deux groupes est maintenant utilisée:
- les lésions de bas grade, ou AIN 1, dans lesquelles les atypies cellulaires sont modérées et localisées au tiers profond de la muqueuse.
- les lésions de haut grade, ou AIN 2 et 3 dans lesquelles les atypies cellulaires sont plus marquées, présentes dans les 2/3 profonds ou la totalité de l’épaisseur de la muqueuse et s’accompagnent d’un pléiomorphisme cellulaire. La désorganisation architecturale est importante avec une basophilie cellulaire diffuse et une dyskératose (Photo n1).
Photographie n°1 : Lésion de néoplasie anale intraépithéliale de haut grade (AIN3) en histologie (cliché ; Pr. Jean-François Fléjou).
Le terme de cancer in situ correspond à une AIN 3 ou à une dysplasie sévère doit être abandonné (Tableau 1). Le terme de maladie de Bowen est employé pour certaines formes d’AIN3 en zone cutanée [1]. Les koïlocytes sont des cellules devenues anormales sous l’effet cytopathogène d’un HPV, elles témoignent d’une infection par un HPV et peuvent être associées aux AIN de bas grade. Ces cellules peuvent également être visibles sur des frottis anaux.
| Dysplasie légère | AIN I | Dysplasie de bas grade | AIN bas grade |
| Dysplasie modérée | AIN II | Dysplasie de haut grade | AIN haut grade |
| Dysplasie sévère | AIN III | ||
| Carcinome in situ |
Tableau 1 : Correspondances des terminologies histologiques de la dysplasie du canal anal.
Physiopathologie et histoire naturelle
Même si le potentiel de dégénérescence et l’histoire naturelle de ces lésions sont mal connus, la filiation dysplasie-cancer paraît analogue à celle de la muqueuse du col utérin et passe elle aussi par une infection persistante à HPV [2-4]. Une quarantaine de génotypes d’HPV infectent les muqueuses génitales (Tableau 2). Les HPV dits « à bas risque » sont à l’origine des lésions condylomateuses ou cutanées et sont le plus souvent spontanément éliminés en quelques mois. Les virus « à haut risque » ont une clairance plus faible, infectent les couches basales de l’épithélium notamment dans la zone de transition entre les épithéliums malpighiens et glandulaires avant de s’intégrer à l’ADN chromosomique. Ces virus sont ainsi associés aux cancers et aux dysplasies du col utérin, de l’anus et de l’oropharynx. Près de 90% des cancers du canal anal sont attribuables à des HPV à haut risque, dont 80% ne seraient dus qu’aux seuls génotypes 16 et 18 [4]. Chez les patients infectés par le virus de l’immunodéficience humaine (VIH), la proportion d’HPV-16 à l’origine d’un carcinome épidermoïde du canal anal parait moindre (60% vs 76 % chez les patients non infectés par le VIH) [5].
| Risque oncogène | Génotypes |
| Elevé | 16, 18 les plus fréquents 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58,59, 66, 68, 73, 82 |
| Indéterminé | 55, 62, 64, 67, 69, 71, 83, 84, 89 |
| Faible | 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 |
Tableau 2 : Liste des principaux Papilloma virus humains infectant les muqueuses ano-génitales et leur potentiel oncogèned
Il n’existe à ce jour aucun taux prospectif connu de progression des AIN. Cependant les taux de progression vers des lésions de haut grade (AIN2/3) chez les patients infectés par le VIH seraient dépendants de l’âge, du nadir des CD4, du stade SIDA, de la durée de la thérapie anti-rétrovirale et la présence d’un génotype à haut risque (HPV-16 et/ou 18) [6]. Une méta-analyse récente a estimé un taux théorique de progression des AIN de haut grade vers le cancer chez les homosexuels masculins (MSM) VIH+ à 1/633 patients-année et 1/377 depuis l’introduction des thérapies anti rétrovirales [7].
Epidémiologie du carcinome épidermoïde du canal anal
Le carcinome épidermoïde du canal anal reste une tumeur peu fréquente représentant environ 2 % des cancers digestifs. Cependant sa prévalence a considérablement augmenté ces 20 dernières années de façon parallèle à l’épidémie par le VIH. Son épidémiologie s’est profondément modifiée, avec une augmentation de sa prévalence à un âge plus précoce (âge médian de 42,2 [33,4-46,5] ans) et surtout une augmentation de sa prévalence chez les hommes, notamment infectés par le VIH, observés dans de nombreux pays y compris en France [8-9]. Le sous groupe le plus à risque est le groupe de patients homosexuels masculins infectés par le VIH. Dans cette population, l’incidence est évaluée de 75 à 137/100 000 personne-année, incidence plus élevée que celle du cancer du col utérin et de 30 à 100 fois celle de la population générale [10-11]. Sa prévalence ne diminue pas avec l’introduction des thérapies anti rétrovirales, mais augmente même avec l’allongement de l’espérance de vie des patients ce qui en fait une préoccupation importante en pratique clinique. Les femmes infectées par le VIH, sont également à risque, ce d’autant qu’elles ont un antécédent de pathologie génitale à HPV : vulvaire (vulvar intraepithelial neoplasia VIN), ou cervicale (cervical intraepithelial neoplasia CIN) et a fortiori CIN de haut grade ayant fait pratiquer une conisation [12].
Epidémiologie de l’infection HPV et des AIN chez les patients infectés par le VIH
De nombreuses études se sont ainsi intéressées à la prévalence de l’infection HPV anale mais aussi à la prévalence des lésions d’AIN dans la population infectée par le VIH et particulièrement chez les MSM.
La prévalence des infections anales à HPV est très élevée chez les MSM VIH+, évaluée entre 72 et 97% et elle ne parait pas diminuer avec l’âge comme cela est observé dans les infections cervicales à HPV, probablement en raison d’une histoire naturelle différente mais aussi en raison de différence de comportement sexuel [6-7,9,13]. La co-infection par plusieurs sérotypes concerne près de 2/3 des patients.
L’incidence des AIN de tout grade évaluée par le frottis anal et confirmée par des biopsies dirigées sous anuscopie de haute résolution (AHR), est évaluée entre 41 et 97% chez les MSM infectés par le VIH, 34% chez les hommes hétérosexuels infectés par le VIH, contre 14 à 28% chez les MSM non infectés par le VIH. Les taux annuels d’incidence des lésions d’AIN de haut grade chez les MSM VIH+ sont élevés, voisins de 20 à 25% et relativement stables entres diverses cohortes [6,14-15]. La prévalence des lésions de haut grade au bout du suivi est voisine de 50% à 3 ou 4 ans [6,13].
Chez les femmes ayant un CIN de haut grade, la prévalence anale d’un HPV a été évaluée à 35% (dont 22% de HPV à haut risque et 12,5% d’association haut et bas risque) [12]. Chez les femmes infectées par le VIH, la prévalence des AIN de tous grades, recherchées par cytologie anale est de 26% mais augmente à 39% en cas de rapports anaux ; la prévalence en histologie des AIN de haut grade est de 10% versus 26% en cas de rapports anaux [16-17].
Recommandations actuelles de dépistage du cancer anal
Le dépistage du cancer anal figure ainsi dans les Recommandations Nationales du Groupe d’Experts sur la Prise en Charge de l’Infection par le VIH en France depuis 2006 [18] et concerne, à ce jour, tous les patients séropositifs : hommes et femmes ayant des rapports anaux réceptifs, des condylomes ano- génitaux ou des antécédents de condylomes, et les femmes avec un antécédent de dysplasie ou de cancer du col. L’examen proctologique standard associant examen de la marge anale, toucher rectal et anuscopie standard est ainsi recommandé annuellement dans cette population [18-19], afin de détecter des formes précoces de carcinome épidermoïde du canal anal, car le pronostic est étroitement lié au stade tumoral au moment du diagnostic avec une médiane de survie à 5 ans de 80% dans les formes localisées non métastasées contre 30% dans les formes métastasées.
Que rechercher lors de l’examen clinique annuel ?
Il est essentiel de réaliser un examen attentif du canal anal, de l’appareil génital (col utérin, vagin, vulve, pénis) et de la bouche, en raison de la possibilité de lésions précancéreuses ou cancéreuses synchrones, mais aussi métachrones (Photo 2). Le taux de CD4 et de la charge virale du VIH sont un bon indicateur du contrôle viral de la maladie. Il convient de s’enquérir du suivi gynécologique des femmes, ou de leur rappeler la nécessité d’un frottis cervico-vaginal régulier. Il est intéressant de rechercher un tabagisme actif, car potentiellement associé à la progression des lésions.
Photographie n°2 : Lésion condylomateuse buccale
Les principaux signes d’appel d’une lésion anale précancéreuse sont le prurit et/ou la perception d’une lésion cutanée.
Les condylomes peuvent être le siège d’AIN, le plus souvent de bas grade, en particulier lorsqu’ils sont situés dans le canal anal en muqueuse transitionnelle où ils peuvent prendre l’aspect de lésions planes ou à peine surélevées (Photo 3).
Photographie n°3 : Lésion condylomateuse à peine surélevée intracanalaire en muqueuse transitionnelle siège néoplasie anale intra épithéliale de bas grade (AIN1) vue en Anuscopie d haute résolution.
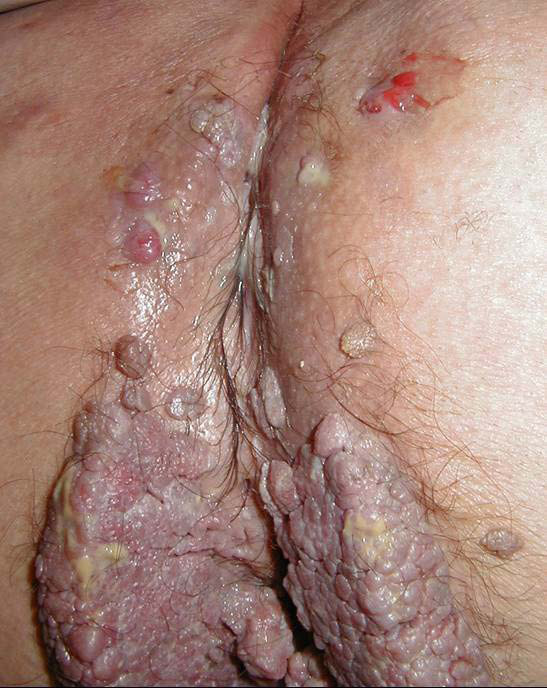
La tumeur de Buschke Lowenstein (nommée aussi selon l’OMS condylome géant) se manifeste sous la forme d’une ou de plusieurs masses péri-anales pouvant mesurer plusieurs centimètres et détruire, par compression, les tissus de voisinage (rectum, vagin…) (Photo 4). Elle est en règle associée aux HPV 6 et 11. Un cancer invasif est de fait retrouvé dans au moins 50% des pièces d’exérèse chirurgicale [20].
Photographie n°4 : Tumeur de Buschke Lowenstein
La maladie de Bowen, AIN3 en zone cutanée, dans la forme la plus typique, réalise une tâche unique lenticulaire bistre ou rosée, puis un placard kératosique à limites nettes qui va apparaître infiltré et saillant (Photo 5a). Cependant, les manifestations sont polymorphes : lésions érythémateuses ou érythémato-squameuses ou érythémato-verruqueuses, lésions ulcérées pseudo-fissuraires, lésions pigmentées. Elles amènent à discuter plusieurs diagnostics différentiels : psoriasis, maladie de Paget extra-mammaire dans les formes érythémateuses, eczéma, mycose dans les formes suintantes. Dans les formes ulcérées, il faut éliminer une fissure atypique, une ulcération d’une infection sexuellement transmissible (IST). Les formes hyperkératosiques peuvent ressembler à des condylomes acuminés, voire à une tumeur végétante.
Photographie n°5 a : Lésion d’AIN3 marginale sans coloration.
Photographie n°5 b : Lésion d’AIN3 marginale après coloration à l’acide acétique.
Photographie n°5 c : Lésion d’AIN3 marginale après coloration à l’acide acétique, vue au filtre vert avec aspect en mosaïque.
Les formes multifocales conduisent à discuter la papulose bowenoïde: IST due aux HPV oncogènes 16, 18, 31, 33. Cette affection de l’adulte jeune, exceptionnelle en dehors de la sphère ano-génito-périnéale, est faite de multiples papules de 1 à 3 mm de diamètre de coloration brune violine en zone cutanée, rouge en zone muqueuse, voire d’aspect leucoplasique (Photo 6). Chez le sujet immunocompétent, la régression spontanée est possible. Elle peut se chroniciser et dégénérer en forme invasive chez le sujet immunodéprimé.
Photographie n°6 : Papulose bowenoïde.
Toute lésion infiltrée, indurée ou d’évolution récente est suspecte d’être invasive et doit être biopsiée sans retard. La présence d’adénopathies inguinales associées est moins discriminante chez le sujet infecté par le VIH. Il faut savoir reprendre un examen quelques semaines après l’arrêt de dermocorticoïdes qui peuvent modifier ou atténuer de façon considérable l’aspect d’une lésion.
On rappelle l’absolue nécessité d’un examen clinique complet et attentif à la recherche d’autres lésions à HPV : ainsi une prévalence de 6,4% de néoplasies intra-épithéliales du pénis (PIN) été rapportée parmi 263 MSM infectés par le VIH et ayant des lésions d’AIN [21].
Peut on améliorer les performances de l’examen clinique ? Sémiologie lésionnelle en AHR
Cependant, si l’examen clinique standard attentif permet le diagnostic de cancer du canal anal ou de lésions macroscopiques précancéreuses, il risque d’ignorer des lésions d’AIN car elles sont le plus souvent infra-cliniques et détectées uniquement par un examen sous colposcope avec coloration à l’acide acétique et lugol, appelé anuscopie de haute résolution (AHR). Ainsi dans une série prospective de 446 hommes VIH+, il apparaissait clairement que le toucher rectal n’avait permis la détection d’aucun des 156 cas d’AIN de haut grade [14].
L’AHR est réalisée à l’aide d’un colposcope à travers l’anuscope sans préparation préalable, mais avec application d’acide acétique dilué à 3 ou 5% et de lugol. Cet examen dure 20 minutes environ. L’acide acétique provoque la coagulation et la précipitation réversible des protéines nucléaires et des cytokératines, induisant un gonflement de l’épithélium glandulaire et une légère coagulation de la couche superficielle de l’épithélium malpighien normal (car contenant peu de noyaux). Dans les zones d’AIN présentant de fortes quantités de protéines nucléaires, la coagulation est plus marquée, provoquant un blanchiment de l’épithélium (Photo 5b). La réaction est d’autant plus rapide et intense que le grade d’AIN est élevé [22]. Cependant l’activité nucléaire est également marquée dans les lésions purement condylomateuses, ou dans un épithélium en cours de cicatrisation et de régénération, associé à une inflammation. L’examen est centré sur l’analyse de l’épithélium et des anomalies vasculaires des zones de l’anus blanchies par l’acide acétique. L’utilisation d’un filtre vert facilite la visualisation des vaisseaux sanguins. Les changements de coloration au Lugol dépendent de la présence ou de l’absence de glycogène dans les cellules épithéliales. Les régions, qui souvent correspondent à une muqueuse normale, contenant du glycogène deviennent brunes ou noires. Les régions touchées par une AIN ou par un cancer invasif, déficientes en glycogène, prennent mal ou pas la coloration et apparaissent de couleur jaune moutarde ou safran, de même que les régions leucoplasiques, ou hyperkératosique. Les condylomes peuvent occasionnellement prendre la coloration à l’iode de façon partielle. Surtout, ce test au Lugol permet de mieux définir les limites anatomiques des zones anormales, facilitant ainsi leur traitement.
Toutes les caractéristiques suivantes doivent être analysées attentivement, afin de diriger d’éventuelles biopsies:
- Les limites des lésions : nettes, régulières, distinctes ou imprécises. Le nombre des lésions et la surface lésée est importante à noter en particulier chez les patients infectés par le VIH, car les lésions sont volontiers extensives et multifocales.
- L’aspect plan ou en relief des anomalies : une lésion plane est 4 fois plus souvent de haut grade que de bas grade [22].
- L’intensité de la réaction acidophile.
- L’aspect de surface des régions acidophiles : lisse, régulier ou nodulaire ; absence ou présence d’excroissances papillaires : une lésion lisse est 2 fois plus souvent de haut grade que de bas grade.
- La présence de vaisseaux rigides ou anormaux formant des motifs divers : épingles à cheveux, crochets, tire-bouchon… d’aspect bien souvent irrégulier. Un autre aspect bien connu des colposcopiste mais plus rare en AHR doit être recherché : il s’agit de la présence d’un aspect en mosaïque ; l’épithélium pathologique apparaît coagulé par l’acide acétique par plages séparées d’un espace plus ou moins fin où l’épithélium est plus mince et le chorion visible par transparence (Photo 5c). L’aspect en ponctuations traduit également des différence d’épaisseur de l’épithélium mais cette fois ci les travées profondes ne sont pas visibles et seul le sommet des axes conjonctivo vasculaire est visible sous la forme d’une zone blanche ponctuée de rouge.
- Les changements de couleur après l’application du soluté de Lugol (Photo 7).
Photographie n°7 : Prise hétérogène de lugol d’une lésion d’AIN2 en zone transitionnelle.
L’AHR nécessite un apprentissage rigoureux, et se développe lentement en France. Il apparaît important de sélectionner les patients qui peuvent en bénéficier à la fois en terme de bénéfice pour le patient et de disponibilité médicale. Cet examen est indiqué soit dans une stratégie de dépistage, soit pour la caractérisation et le suivi de lésions d’AIN.
A qui proposer une AHR ?
Figure 1 : Stratégie de dépistage et de prise en charge des AIN chez les patients infectés par le VIH, d’après Park[11]
Il est clair que le recours à l’AHR ne doit pas être systématique mais véritablement s’inscrire dans un algorithme de dépistage et de prise en charge. Celui-ci s’inspire largement du dépistage des lésions cervicales en associant une étude cytologique d’un frottis anal suivie d’AHR en cas d’anomalie. Il a été proposé dans les populations à risque élevé, à savoir les homosexuels masculins et les patients infectés par le VIH [10-11, 23] (Figure 1). Les cellules sont recueillies par une brosse en dacron introduite dans le canal anal sans désinfection préalable ni pose d’écarteur. Cette brosse est tournée plusieurs fois dans le canal avant d’être plongée dans le liquide de cytologie (Photo 8). Après centrifugation, sédimentation en couche mince, le frottis est coloré par la méthode de Papanicolaou (Photo 9). Les techniques en couche mince sont comparables aux techniques en phase liquide. Les lésions cytologiques sont classées en fonction des atypies cellulaires selon le système de Bethesda modifié en [24] :
- Lésions de bas grade ou LSIL (low-grade squamous intraepithelial lesion)
- Lésions de haut grade ou HSIL (high-grade squamous intraepithelial lesion)
- Lésions de signification indéterminée ou ASCUS (atypical squamous cell of undetermined significance) quand les lésions ne remplissent pas tous les critères diagnostiques de lésions de bas grade ou de haut grade. Ces lésions ne doivent pas être négligées car elles peuvent être associées à des lésions de haut grade en histologie. Ainsi tout frottis anormal doit faire pratiquer une AHR [11].
La cytologie anale est un examen facile à réaliser, indolore et bien accepté. La réalisation du frottis par le patient lui-même est possible avec une qualité des frottis similaire. La répétition du frottis à 2 ans d’intervalle permet d’augmenter ses performances. Le coût d’un frottis anal est équivalent à celui d’un frottis cervical. Il nécessite l’achat de matériel de prélèvement et d’un milieu de conservation adéquat, l’acheminement au laboratoire, la préparation du matériel en monocouche avant la lecture par le cytopathologiste. Des automates peuvent éventuellement être utilisés.
La sensibilité de la cytologie anale pour détecter des AIN est voisine de 69 à 93% chez les MSM infectés par le VIH. La spécificité est moins bonne, de 32 à 64%, en raison d’une mauvaise corrélation entre le grade des anomalies cytologiques et histologiques, en particulier car les frottis classés ASCUS sont plus fréquents qu’en pathologie cervicales et ne permettent pas d’éliminer une lésion de haut grade, imposant de fait une AHR [11]. Le rapport coût-efficacité du dépistage est comparable à celui d’autres procédures de dépistage comme celle du cancer colo-rectal en population générale ou de la prophylaxie de la pneumocystose pulmonaire. L’apport dans les stratégies de dépistage de la recherche des HPV et notamment des HPV à haut risque n’est pas clair dans cette population où la prévalence des HPV anaux est très élevée et ne doit pas être réalisé en dehors du champ de la recherche.
Photographie n°8 : Matériel pour cytologie anale
Photographie n°9 : Frottis anal (Cliché : Dr Sarra Vuong)
Peut-on recommander une stratégie de dépistage des AIN ?
Les recommandations de dépistage ne font actuellement l’objet d’aucun consensus international : il faut cependant bien distinguer si l’objectif est de dépister le cancer du canal anal à un stade précoce ou s’il est de dépister des lésions anales précancéreuses. Certaines équipes ont mis en place un programme de dépistage associant frottis tous les 1 à 2 ans, suivi d’une AHR en cas d’anomalie et traitement le plus souvent par destruction infra rouge guidée sous AHR de toutes les lésions de haut grade détectées. Une étude de cohorte a permis d’évaluer à long terme les effets d’une prise en charge associant dépistage précoce des lésions par AHR et traitement itératifs dans une population de 246 patients traités pour des lésions d’AIN de haut grade suivis 10 ans [25]. Une exérèse chirurgicale des lésions était pratiquée suivie de la destruction itérative de toute nouvelle lésion détectée par AHR. Le taux de récidive des lésions de haut grade était de 57% dans un délai de 19 [3-92] mois. Un suivi intensif clinique et cytologique était proposé avec un recours régulier (tous les 4 à 6 mois) à l’AHR permettant d’améliorer les performances diagnostiques et de traiter précocement toute nouvelle lésion par photocoagulation infrarouge ou par électrodestruction sous anesthésie locale en consultation ou au bloc opératoire selon l’étendue des lésions. A la fin du suivi 78% des patients n’avaient plus de lésion de haut grade détectable, seuls 10% des patients ont eu un geste de résection chirurgicale complémentaire et 1,2% avaient développé un cancer invasif (3 cas dont 2 perdus de vus à 14 et 19 mois). Cependant l’adhésion complète au rythme de dépistage imposé dans l’étude n’était le cas que de 19% des patients, les autres ayant un rythme de suivi moins régulier. La compliance des patients est en effet indispensable à une bonne qualité de dépistage. Outre la rareté des ressources en AHR en France, l’absence de traitement efficace des AIN et la difficulté à démontrer un impact sur la mortalité par cancer du canal anal freine l’adoption d’une telle politique de dépistage. L’évaluation de cette politique est difficile et dans les villes où elle a été adoptée, l’incidence des AIN de haut grade a augmenté sans modifier réellement pour l’instant le nombre de cancer épidermoïde du canal anal [26].
Comment affirmer le diagnostic d’AIN ?
La sémiologie en AHR permet de détecter les lésions et de reconnaître des lésions de bas grade et de haut grade. Cependant le diagnostic d’AIN repose sur l’examen histologique de biopsies ou sur celui d’une pièce d’exérèse chirurgicale. L’intégrité de la membrane basale, indispensable au diagnostic, ne peut en effet être affirmée que sur l’analyse de la totalité d’une pièce opératoire large, passant à 1/2 cm des limites pathologiques macroscopiquement décelables et avec des limites latérales d’exérèse saines. Pour affiner le diagnostic d’AIN, il est proposé de s’aider par la recherche, en immunohistochimie, de la présence des marqueurs p16 et Ki-67; marqueurs qui permettent, lorsqu’ils sont présents, d’améliorer la reproductibilité du diagnostic [27]. La difficulté essentielle du diagnostic d’AIN réside dans la difficile reproductibilité de leur classification, aussi bien en intra- qu’en inter-observateur qui amène souvent à une double lecture systématique par un second expert [28]. La réalisation isolée d’un frottis ne permet pas d’affirmer le diagnostic, et doit être suivie d’une AHR avec biopsies dirigées.
Comment traiter ces lésions ?
Le traitement est mal codifié et souvent peu ou mal évalué (études rétrospectives, absence de groupe témoin, effectifs faibles, absence da caractérisation du grade des AIN…) avec des taux de succès variables mais dans tous les cas un fort taux de récidive, lié à la persistance de l’infection HPV. Théoriquement, une pièce d’exérèse chirurgicale large, permettant de vérifier l’absence de franchissement de la membrane basale est nécessaire au diagnostic : le traitement est ainsi réalisé dans le même temps. Cependant cette attitude, si elle encore possible devant des lésions de petite taille occupant moins du tiers de la circonférence anale, doit être très clairement nuancée chez les patients infectés par le VIH en raison du problème essentiel lié au risque élevé de récidive des lésions et de leur caractère étendu et/ou multifocal qui exposent les patients à une morbidité importante de la chirurgie d’exérèse répétée, avec un risque de sténose anale et/ou des troubles de la continence anale par altération, de la muqueuse anale sensible [29]. Ainsi certaines équipes ayant une grande expérience de la sémiologie lésionnelle en AHR ne biopsient même pas les lésions de bas grade typiques mais uniquement les lésions de haut grade pour limiter le nombre de biopsies en raison du caractère délétère des prélèvements répétés.
Parmi les méthodes de destruction, l’électrodestruction est communément utilisée mais la photocoagulation infrarouge censée être plus superficielle se développe dans cette indication avec un taux de rémission de 62% à un an contre 86% de rémission à 3 ans pour la chirurgie [30]. L’absence d’analyse histologique est leur principale limite, avec le risque de méconnaître une lésion invasive.
Des méthodes de destruction chimique existent : l’acide trichloracétique est utilisé avec une efficacité rapportée de 71% à un an mais nécessite des applications répétées avec la possible apparition de lésions cicatricielles. L’application de 5FU en crème a également été rapportée [31].
L’imiquimod a des propriétés immunomodulatrices locales et son utilisation a été validée dans le traitement des condylomes et des néoplasies intra-épithéliales de haut grade de la vulve (VIN) [32]. Un essai thérapeutique randomisé en double aveugle contre placebo a permis d’inclure 64 patients homosexuels masculins infectés par le VIH ayant des lésions d’AIN de haut grade, traités pendant au moins 12 semaines [33]. Après un suivi médian de 33 mois les patients ont vu disparaître (4/28) ou diminuer le grade de sévérité de leurs lésions (8/28) dans 43% des cas versus 4% avec le placebo (p<0,05). Les patients du groupe placebo ensuite traités en ouvert par Imiquimod ont obtenu les mêmes résultats. Parmi tous les patients traités, 61% n’avaient plus de lésions de haut grade en fin de suivi [33]. Si ces résultats sont encourageants, il faut cependant rappeler que l’imiquimod n’a pas l’autorisation de mise sur le marché pour le traitement des condylomes intra-canalaires, ni bien sûr pour le traitement des AIN.
Cependant aucun de ces traitements ne permet l’éradication des HPV et à moyen terme (30 mois) 50 % des patients développent des lésions de haut grade sur un site non traité [11]. Ce taux de récidive atteint 61% à un an après traitement par coagulation infrarouge chez les MSM VIH+ [30] et des lésions métachrones sont observées dans 82% des cas dans cette population après un premier traitement. Des pistes vaccinales ont ainsi été étudiées ; l’utilisation de vaccin thérapeutique contre les protéines E6 ou E7 bloquant la réplication virale reste limitée à de très faibles séries. Par contre le vaccin tétravalent contre les HPV 16, 18, 6 et 11 (Gardasil®) a été utilisé sur de plus larges séries et a montré sur 202 patients avec un suivi de 304 personnes années, une réduction du taux de récidive des AIN de haut grade (13,6% vs 30,7% dans le groupe non vacciné) [34]. Il n’est pas actuellement recommandé de vacciner les patients infectés par un HPV, ayant des condylomes ou une AIN. Un essai randomisé contre placebo du vaccin tétravalent a montré l’effet protecteur du vaccin avec 77,5 % d’efficacité sur la survenue d’AIN en l’absence d’infection HPV préexistante dans un sous groupe de 602 MSM âgés de 16 à 26 ans [35]. Ceci a conduit la FDA à approuver la vaccination préventive des jeunes garçons aux Etats-Unis avant les premiers rapports sexuels ce qui n’est pas le casen Franceoù elle est recommandée seulement chez les filles.
A contrario devant l’absence de traitement satisfaisant des AIN, en raison du risque élevé de récidive et/ou du caractère délétère des traitements répétés, quelques auteurs ont évalué les résultats d’une surveillance simple des AIN de haut grade, notamment chez les patients infectés par le VIH [36]: parmi 40 hommes VIH+ suivis pendant 13 à 130 mois, avec une médiane de suivi de 32 mois, trois (7,5%) ont développé un carcinome épidermoïde du canal anal entre 8 et 84 mois après l’entrée dans l’étude alors que tous avaient une AIN de haut grade à l’entrée dans l’étude (depuis une date non connue) et pour 2 d’entre eux avec une atteinte multifocale. Ces trois patients ont été guéris par l’exérèse chirurgicale simple de la lésion (T1) dans 2 cas ou par radiochimiothérapie dans le dernier cas, et étaient vivants à la fin du suivi. Il est important de noter que dans cette étude, tous les patients inclus avaient des lésions macroscopiques et pour la plupart symptomatiques ; aucun patient n’avait bénéficié d’un examen systématique de dépistage ou d’une AHR à aucun moment du suivi [36].
Il n’existe aucun essai comparatif permettant de recommander un traitement et en pratique le traitement est souvent décidé au cas par cas en fonction du terrain, de l’étendue des lésions et du résultat ou de la tolérance d’éventuels traitements antérieurs. Qu’elle que soit l’option thérapeutique choisie il est essentiel d’informer le patient du risque de dégénérescence et de le convaincre de la nécessité d’un suivi à vie. Même si cela n’a pas été démontré, il parait probablement utile de l’encourager à arrêter de fumer.
Comment suivre les patients après traitement d’une AIN
Cette prise en charge ne fait l’objet d’aucune recommandation. Néanmoins, il parait raisonnable de recommander chez les patients infectés par le VIH, un suivi semestriel en cas d’AIN de haut grade, la médiane de survenue d’un cancer étant de 8,6 mois dans une cohorte de patients suivis [11, 14,18]. En pratique il est difficile d’imposer le même rythme à des patients ayant une fois au cours du suivi, une AIN de bas grade, sans récidive et après plusieurs examens semestriels normaux, le rythme de suivi pourra redevenir annuel. Le suivi fait appel dans tous les cas à l’examen proctologique « standard » (inspection, toucher rectal et anuscopie) avec examen des organes génitaux et de la cavité buccale [18]. En cas de disponibilité du frottis et de l’AHR, on peut proposer une AHR 6 mois après le traitement d’une lésion de haut grade. Après une, voire 2, AHR normales, une nouvelle AHR ne sera réalisée qu’en cas d’anomalie du frottis anal annuel ou en cas d’apparition d’une lésion suspecte d’AIN à l’examen standard.
Conclusion
En raison d’une forte augmentation de sa prévalence dans la population infectée par le VIH, le dépistage du carcinome épidermoïde du canal anal concerne tous les gastro-entérologues puis qu’un examen proctologique standard annuel est recommandé dans cette population. La reconnaissance de lésions anales précancéreuses ou AIN est essentielle à la bonne prise en charge des patients. Toute lésion macroscopique persistante devra faire pratiquer une biopsie car le diagnostic d’AIN est histologique. Le dépistage par cytologie anale, suivie d’une AHR avec biopsies dirigées en cas d’anomalie permet de détecter et de traiter des lésions d’AIN à un stade plus précoce. Cependant cette stratégie pour de multiples raisons ne fait pas encore l’objet d’un consensus international, en partie car le taux de récidive après traitement des AIN est élevé et qu’il est difficile de montrer que cette attitude diminue la mortalité par cancer épidermoïde du canal anal. Néanmoins les similitudes avec la pathologie cervicale et le bénéfice du dépistage des lésions cervicales à HPV, laissent présager le développement d’algorithmes de dépistage et de suivi accordant une place grandissante à la cytologie anale et l’anuscopie de haute résolution dans la prise en charge des lésions anales intra épithéliales des sujets à haut risque de cancer du canal que sont les patients infectés par le VIH.
Références
- Welton M, Amerhauser A, Litle V, et al. Anal Bowen’s disease and high-grade squamous intraepithelial lesions are histologically and immunohistochemically indistinguishable. Dis Colon Rectum 2001;44:A27-59.
- Frisch M, Fenger C, Van Den Brule AJ, et al. Variants of squamous cell carcinoma of the anal canal and perianal skin and their relation to human papillomaviruses. Cancer Res 1999;59:753-7.
- Clifford GM, Smith JS, Aguado T, et al. Comparaison of HPV type distribution in high-grade cervical lesionsand cervical cancer: a meta-analysis.Br J Cancer 2003; 89:101-5.
- De Vuyst H, Clifford GM, Nascimento MC, Madeleine MM, Franceschi S. Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva, vagina and anus: a meta-analysis. International journal of cancer. 2009 ;124:1626-36.
- Abramowitz L, Jacquard AC, Jaroud F, Haesebaert J, Siproudhis L, Pradat P et al. Human Papillomavirus genotype distribution in anal cancer in France. Int J Cancer 2011.129:433-9.
- de Pokomandy A, Rouleau D, Ghattas G, Trottier H, Vezina S, Cote P, et al. HAART and Progression to High-Grade Anal Intraepithelial Neoplasia in Men Who Have Sex with Men and Are Infected with HIV. Clin Infect Dis. 2011 Mar 1.
- Machalec DA, Poynten M, Jin F, Fairley CK, Farnsworth A, Garland SM, et al. Anal human papillomavirus infection and associated neoplastic lesions in men who have sex with men: a systematic review and meta-analysis. Lancet Oncol 2012 DOI:10.1016/S1470-2045(12)70080-3.
- Shiels MS, Pfeiffer RM, Geul MH, Hall Ji, Li J, Chatravedi AK et al. Cancer burden in the HIV infected population in the United States. J Nat Cancer Inst 2011; 103:753-62.
- Piketty C, Selinger-Leneman H, Grabar S, Duvivier C, Bonmarchand M, Abramowitz L, et al. Marked increase in the incidence of invasive anal cancer among HIV-infected patients despite treatment with combination antiretroviral therapy. AIDS. 2008;22:1203-11.
- Palefsky JM. Anal cancer prevention in HIV-positive men and women. Cur Opin Oncol 2009;21:433-8.
- Park IU, Palefsky JM. Evaluation and Management of Anal Intraepithelial Neoplasia in HIV-Negative and HIV-Positive Men Who Have Sex with Men. Curr Infect Dis Rep. 2010;12:126-33.
- Veo CA, Saad SS, Nicolau SM, et al. Study on the prevalence of human papillomavirus in the anal canal of women with cervical intraepithelial neoplasia grade III. Eur J Obstet Gynecol Reprod Biol 2008;140:103-7.
- Palefsky JM, Holly E, Ralston MR, et al. High incidence of anal high grade squamous intraepithelial lesions among HIV-positive and HIV-negative homosexual and bisexual men. AIDS 1998;12:495-503.
- Kreuter A, Potthoff A, Brockmeyer NH, Gambichler T, Swoboda J, Stucker M, et al. Anal carcinoma in human immunodeficiency virus-positive men: results of a prospective study from Germany. Br J Dermatol. 2010;162:1269-77.
- Salit IE, Lytwyn A, Raboud J, Sano M, Chong S, Diong C, et al. The role of cytology (Pap tests) and human papillomavirus testing in anal cancer screening. AIDS. 2010 ;24:1307-13.
- Holly EA, Ralston ML, Darrahg TM, et al. Prevalence and risk factors for anal squamous intraepithelial lesions in women. J Natl Cancer Inst 2001;93:843-9.
- Piketty C, Darragh TM, Da Costa M, et al. High prevalence of anal human papillomavirus infection and anal cancer precursors among HIV-infected persons in the absence of anal intercourse. Ann Intern Med 2003;138 :453-9.
- Rapport 2010 sur la prise en charge médicale des personnes inféctées par le VIH sous la direction du Pr P Yéni. www.sante.gouv.fr/rapport-2010-sur-la-prise-en-charge-médicale-des-personnes-inféctées-par-le-VIH-sous-la-direction-du-pr-patrick-yeni.html
- Le proctologue-gastroentérologue acteur de la prévention du cancer de l’anus auprès des patients infectés par le VIH. Institut national du cancer. www.e-cancer.fr.
- Trombetta LJ, Place RJ. Giant condyloma acuminatum of the anorectum : trends in epidemiology and management. Dis Colon Rectum 2001;44:1878-86.
- Penile intraepithelial neoplasia is frequent in HIV-positive men with anal dysplasia. J Invest Dermatol. 2008;128:2316-24.
- Jay N, Berry JM, Hogeboom CJ, et al. Colposcopic appearance of anal squamous intraepithelial lesions: relationship to histopathology. Dis Colon Rectum 1997;40:919-28.
- Chiao EY, Giordano TP, Palefsky JM, et al. H. Screening HIV-infected individuals for anal cancer precursor lesions: a systematic review. Clin Infect Dis 2006;43:223-33.
- Solomon D, Davey D, Kurman R, et al. The 2001 Bethesda System: terminology for reporting results of cervical cytology. JAMA 2002;287:2140-1.
- Pineda CE, Berry JM, Jay N, et al. High-resolution anoscopy targeted surgical destruction of anal high-grade squamous intraepithelial lesions: a ten-year experience. Dis Colon Rectum 2008;51:829-35.
- Katz KA, Clarke CA, Bernstein KT, Katz MH, Klausner JD. Is there a proven link between anal cancer screening and reduced morbidity or mortality? Ann Intern Med. 2009 17;150:283-4; author reply 4-5.
- Bean S, Meara R, Vollmer RT et al. P16 improves interobserver agreement in diagnosis of anal intraepithelial neoplasia. J Low Genit Tract Dis 2009;13:145-53.
- Colquhoun P, Nogueras JJ, Dipasquale B, et al. Interobserver and intraobserver bias exists in the interpretation of anal dysplasia. Dis Colon Rectum 2003;46:1332-6.
- Watson AJ, Smith BB, Whitehead MR Sykes PH, Frizelle FA. Malignant progression of anal intra-epithelial neoplasia. ANZ J Surg 2006;76:715-7.
- Goldstone RN, Goldstone AB, Russ J, Golstone SE. Long-term follow-up of infrared coagulator ablation of anal high grade dysplasia in men who have sex with men. Dis Colon Rectum 2011;54:1284-92.
- Richel O, Wieland U, de Vries HJ, Brockmeyer NH, van Noesel C, Potthoff A et al. Topical 5-Fluorouracil treatment of anal intraepithelial neoplasia in human immunodeficiency vius positive men. BR J Dermatol 2010; 163:1301-7.
- van Seters M, van Beurden M, ten Kate FJ, et al. Treatment of vulvar intraepithelial neoplasia with topical imiquimod. N Engl J Med 2008;358:1465-73.
- Fox PA, Seet JE, Stebbing J, et al. The value of anal cytology and human papillomavirus typing in the detection of anal intraepithelial neoplasia: a review of cases from an anoscopy clinic. Sex Transm Infect 2005;81:142-6.
- Swedish KA, Factor SH, Goldstone SE. Prevention of recurrent high grade anal neoplasia with quadrivalent HPV vaccination of men who have sex with men: a non concurrent cohort study. Clin Infect Dis 2012;54:891-8.
- Palefsky JM, Giuliano AR, Goldstone S, Moreira ED, Aranda C, Jessen H et al. HPV vaccine against anal HPV infection and anal intraepithelial neoplasia. N Engl J mad 2011;365:1576-85.
- Devaraj B, Cosman BC. Expectant management of anal squamous dysplasia in patients with HIV.Dis Colon Rectum 2006;49:36-40.
Les 5 points forts
- Les lésions anales précancéreuses (ou AIN : anal intra épithelial néoplasia) sont liées à une infection persistante par un Papilloma virus oncogène et sont extrêmement fréquentes dans la population infectée par le VIH.
- Compte tenu du risque élevé d’AIN et de cancer épidermoïde du canal anal, tous les patients infectés par le VIH doivent au minimum avoir un examen proctologique annuel à vie. En cas d’AIN de haut grade, cet examen devient semestriel.
- Il faut se méfier de toute lésion anale prurigineuse ou persistante, et pratiquer des biopsies, après arrêt des corticoïdes locaux.
- Il est essentiel de rechercher d’autres lésions à HPV en réalisant un examen génital et buccal complet et en demandant un frottis cervical chez la femme.
- Une stratégie s’inspirant du dépistage des lésions cervicales en associant réalisation d’un frottis et en cas d’anomalie, anuscopie de haute résolution avec biopsies dirigées permet de sensibiliser la détection des lésions. Cependant aucun consensus international n’existe concernant le dépistage et la prise en charge des AIN.
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION








![Figure 1 : Stratégie de dépistage et de prise en charge des AIN chez les patients infectés par le VIH, d’après Park[11]](http://www.fmcgastro.org/wp-content/uploads/image/texte_postu_2013/etienney-fig-0.jpg)

