Maladie de Crohn du grêle
Objectifs pédagogiques
- Connaître les risques évolutifs de la maladie de Crohn du grêle
- Connaître l’apport des nouvelles techniques d’imagerie du grêle, en particulier l’entéroIRM et la capsule pour le diagnostic et le suivi de la maladie de Crohn
- Connaître les particularités thérapeutiques de la maladie de Crohn du grêle
Introduction
La maladie de Crohn (MC) est une maladie inflammatoire chronique de l’intestin (MICI) touchant habituellement des sujets jeunes, le pic diagnostic se situant autour de 30 ans. Le sex-ratio homme/femme pour la MC est à 0,8. L’incidence annuelle de la maladie, en augmentation dans les pays développés, est voisine de 5,6/100 000 habitants en France [1, 2]. Elle a augmenté de 1988 à 1999 pour se stabiliser ensuite, sauf pour le taux des formes pédiatriques (moins de 20 ans) qui continue d’augmenter. Elle est en augmentation dans les pays récemment industrialisés, comme la Croatie ou l’incidence de la maladie a été multipliée par 10 entre 1980 et 2000. En France, la MC affecterait 80 000 à 100 000 personnes.
La MC est responsable d’une inflammation chronique de la paroi intestinale qui conduit progressivement à une perte du fonctionnement physiologique de l’intestin. L’évolution de la maladie au cours du temps est associée à l’apparition de complications intestinales représentées par les sténoses, les perforations et les abcès abdominaux ou pelviens. Ces complications, détectées tardivement dans la majorité des cas, rendent souvent nécessaire le recours à la chirurgie. Ainsi, plus de 60 % des patients atteints de MC seront opérés au moins une fois dans leur vie [3] et un malade sur deux subira une 2e résection intestinale dans les 10 années qui suivent la première chirurgie [4]. Les résections itératives pouvant conduire à une insuffisance intestinale par syndrome de grêle court doivent être évitées au maximum. Ainsi, l’objectif ne devrait plus être de surveiller les malades afin de diagnostiquer ces complications et les traiter précocement, mais d’identifier les lésions susceptibles de conduire à ces complications afin d’intervenir au plus tôt pour bloquer l’évolutivité de la maladie. Ainsi, afin de prévenir la destruction intestinale, l’introduction des traitements majeurs (immunosuppresseurs, biothérapie) devrait être envisagée suffisamment tôt chez des patients à risque bien sélectionnés et leur impact mesuré sur des critères morphologiques.
Risques évolutifs de la maladie de Crohn du grêle
On considère que le terme MC regroupe deux entités distinctes : la forme iléale (ou iléocæcale) et la forme colique pure. La localisation initiale de la maladie (iléale ou colique) reste globalement stable dans le temps, avec moins de 15 % d’évolution d’une forme à l’autre au terme de 10 ans de suivi [5]. L’atteinte iléale représente la localisation la plus fréquente de la MC, deux malades sur trois ayant une atteinte de l’intestin grêle [6]. Les malades présentant une forme intestinale de MC ont un risque plus élevé : (a) d’hospitalisations, (b) de survenue de complications de type sténoses, fistules et abcès ; (c) de recours à une chirurgie d’exérèse intestinale [3, 7]. Le risque cumulé de première résection intestinale a été récemment évalué dans une étude en population à 17 % à 1 an, 46 % à 10 ans et 64 % à 20 ans [3].
La classification de Montréal distingue trois phénotypes selon les caractéristiques initiales de la maladie : sténosant, fistulisant et inflammatoire [8]. Néanmoins, la majorité des patients atteint de MC développe une complication de type sténose et/ou fistule au cours de leur histoire, indépendamment des caractéristiques initiales de la maladie [5, 9].
Formes sténosantes de la MC du grêle
En cas d’atteinte iléale de la MC, le phénotype sténosant est observé dans 15 % des cas au diagnostic et dans 43 % des cas après 10 ans d’évolution (Tableau 1) [5]. La manifestation clinique caractéristique d’une sténose du grêle est le syndrome de König. Ce terme imprécis n’ayant pas de définition consensuelle (en termes de localisation, de temps de survenue par rapport au repas et de durée de l’épisode douloureux), devrait être remplacé par celui de « blocage intestinal ». En effet, les formes sténosantes de MC se traduisent le plus souvent par une douleur postprandiale associée à une sensation de blocage des gaz, le tout cédant dans une débâcle gazeuse ou fécale*. Cependant, il n’existe pas de parallélisme entre la présence de sténose, la sévérité anatomique et l’expression clinique. En effet, certaines sténoses serrées peuvent être totalement asymptomatiques ou se traduire par de simples épisodes de diarrhée. Ainsi, tout épisode douloureux ou diarrhéique franc, en dehors d’un épisode évocateur d’une perforation intestinale, doit faire évoquer la survenue ou la majoration d’une sténose iléale.
Formes fistulisantes de la MC du grêle
Il a été montré que le risque de développer une fistule intestinale était significativement plus élevé en cas d’atteinte iléale qu’en cas d’atteinte colique pure [7]. Dans une étude en population évaluant l’histoire naturelle de la MC fistulisante incluant 169 patients suivis de 1970 à 1993, 59 (35 %) patients ont développé une fistule, localisée au niveau de l’intestin grêle dans 36 % des cas ([fistule entéroentérale (24 %), entérocutanée (6 %), entérovésicale (3 %) et entéroabdominale (3 %]) [10]. En fait, les fistules intestinales sont la complication d’une sténose dans près de 90 % des cas [11].
Les abcès intra-abdominaux ou pelviens surviennent chez 10 à 30 % des patients atteints de maladie de Crohn. Ils sont consécutifs à une inflammation transmurale de la paroi intestinale qui aboutit à une perforation avec suppuration intrapéritonéale. La majorité des abcès intra-abdominaux se développe aux dépends de l’iléon terminal. Une suppuration intraabdominale doit être suspectée chez un malade présentant une douleur abdominale aiguë inhabituelle, associée à des signes généraux et de la fièvre. Le diagnostic positif est facilement obtenu par une échographie abdominale ou, mieux, une tomodensitométrie identifiant la collection abcédée au contact d’une anse grêle [12].
Connaître l’apport des nouvelles techniques d’imagerie du grêle, particulièrement l’entéroIRM et la capsule pour le diagnostic et le suivi de la maladie de Crohn
Le transit baryté de l’intestin grêle et le lavement baryté sont des techniques exigeant du temps, des radiologues expérimentés (de moins en moins nombreux pour ces techniques anciennes) et ne permettent d’obtenir qu’une évaluation indirecte des lésions de la paroi intestinale. Ces examens ont été complètement supplantés par les techniques d’imagerie en coupe, à savoir l’échographie, la tomodensitométrie et l’IRM.
L’échographie abdominale fournit des renseignements précis sur la paroi intestinale et la présence de complications à type de sténose et d’abcès [13]. Cependant, elle est difficilement réalisée dans des conditions standardisées, et ne permet pas une cartographie des lésions, car sa sensibilité varie en fonction de la localisation des lésions, bonne au niveau de l’iléon et du côlon droit, et insuffisante pour les autres segments. Ses indications actuelles se limitent à la recherche d’un abcès intra-abdominal si la tomodensitométrie n’est pas disponible, ou chez l’enfant chez qui les autres techniques sont difficiles à réaliser. L’échographie de contraste est en développement et semble bien adaptée à l’évaluation de l’inflammation intestinale au cours de la maladie de Crohn [14].
L’entéroscanner
La tomodensitométrie abdominale, avec une sensibilité et une spécificité supérieures à 80 % pour la détection des segments intestinaux pathologiques (en particulier pour la détection des lésions précoces) est un bon examen chez les patients atteints de MC [15]. Cependant, un travail publié en 2007 a mis l’accent sur le risque potentiel d’augmentation de cancers digestifs par l’utilisation répétée de la tomodensitométrie abdominale, essentiellement chez les sujets jeunes [16]. Ce risque, même s’il reste faible et encore théorique, doit être pris au sérieux dans la MC car la population concernée est jeune et les explorations risquent d’être renouvelées au cours du suivi [17]. Aussi, le consensus ECCO 2010 suggère d’éviter les examens irradiants dans cette population [12].
L’entéroIRM
L’ingestion orale de 1 à 1,5 litre de PEG 4000, de mannitol ou de méthylcellulose est aujourd’hui la méthode la plus utilisée pour obtenir un bon remplissage des anses grêles. L’utilisation d’une sonde d’intubation gastrique ou duodénale, a été abandonnée par la plupart des centres car les patients tolèrent mal cette contrainte. De plus, les résultats obtenus avec l’entéroIRM sont bons et comparables à ceux obtenus avec l’entéroscanner [15]. En effet, l’IRM présente une sensibilité et une spécificité de 93 % pour le diagnostic de MC [15]. Nous avons récemment publié une étude comparant les données de l’entéroIRM à l’examen anatomopathologique des pièces de résection intestinale chez 52 patients opérés pour MC du grêle [18]. Un épaississement de la paroi intestinale = 6 mm permettait de faire la distinction entre une maladie inflammatoire active et inactive et un épaississement = 11 mm permettait le diagnostic des lésions sévères. L’IRM permettait de faire le diagnostic de fistules et/ou d’abcès avec une sensibilité de 88 % et une spécificité de 93 %. Il est important de noter que la présence d’une inflammation aiguë était fortement corrélée à la présence de fibrose, suggérant qu’il n’est pas pertinent de faire une distinction stricte entre les patients présentant des lésions inflammatoires et ceux présentant des lésions fibreuses. L’entéroIRM apparaît donc être la technique la plus adaptée à l’exploration du grêle au cours de la MC car elle permet de diagnostiquer les lésions intestinales avec une forte précision et n’expose à aucune irradiation. Elle peut ainsi être répétée pour évaluer l’évolution des lésions.
La capsule endoscopique (CE)
L’intérêt principal de la CE dans la MC est de fournir une exploration endoluminale et non invasive de l’intestin grêle. La CE a une meilleure sensibilité que l’entéroIRM et l’entéroscanner pour le diagnostic des lésions muqueuses superficielles de la MC [19]. Ainsi, en cas de suspicion de MC, une CE normale rend le diagnostic peu probable [20]. Néanmoins, les lésions observées par CE ne sont pas spécifiques et aucun critère diagnostic formel n’a été validé pour le diagnostic de MC, ceci étant à l’origine d’un nombre important de faux positifs. Les nouvelles recommandations de l’OMED et d’ECCO publiées en 2009 ne préconisent la réalisation de la VC qu’en cas de forte suspicion clinique et biologique de MC, si les examens endoscopiques standards et les examens d’imagerie de l’intestin grêle sont négatifs [20].
En cas de MC connue, il n’existe pas de score de sévérité validé dans l’exploration de l’intestin grêle par CE. Une étude du GETAID en cours devrait permettre d ’ici 2012 de valider un score de sévérité, avec étude de la reproductibilité et évaluation de l’intensité des lésions du grêle au cours de la MC. Les indications de la CE lors du suivi de la MC restent limitées. Elle pourrait être utile à évaluer la cicatrisation muqueuse sous traitement, ou la récidive postopératoire de la maladie si l’iléocoloscopie est impossible ou contre-indiquée [20].
Les contre-indications de la CE sont centrées sur le risque de blocage de la capsule au cours de la traversée du grêle. En cas de suspicion de MC, le risque de rétention de la CE est similaire à celui observé en cas de saignements digestifs inexpliqués (< 5 %), mais ce risque atteint 13 % en cas de MC avérée [20]. Avant de pratiquer une CE, il est donc indispensable de s’assurer de l’absence de toute sténose de l’intestin grêle par les examens radiologiques (entéroIRM ou entéroscanner) et au mieux après ingestion d’une capsule de calibrage, la « patency ».
Développement d’un score de destruction intestinale dans la MC
Dans la polyarthrite rhumatoïde, un score de destruction radiologique (score de Sharp-van der Heijde) permettant d’évaluer la progression de la maladie a été validé [21]. Ce score a permis de montrer que l’utilisation précoce des traitements majeurs était associée à une diminution de la destruction articulaire [22]. Aujourd’hui, grâce à l’entéroIRM, il est possible de visualiser l’épaississement pariétal, la présence de sténoses, les modifications de la graisse et des méso au pourtour des segments digestifs, la présence de fistules ou d’abcès et de distinguer les lésions actives, inflammatoires, des lésions fibreuses, cicatricielles. Nous disposons donc enfin d’un moyen d’évaluation de l’ensemble de la paroi intestinale par un examen peu invasif, pouvant être répété régulièrement chez un même patient, et permettant d’apprécier l’accumulation des complications sténosantes et fistulisantes au cours de l’évolution de la maladie. Ainsi, les conditions nécessaires à l’élaboration d’un score de destruction digestive dans la MC, similaire au score de Sharp de la polyarthrite rhumatoïde, sont réunies. Pour être validé, un tel score devra être capable : (a) d’identifier les lésions digestives irréversibles à un temps donné dans l’histoire de la maladie, (b) d’évaluer la progression des lésions de destruction intestinale dans le temps au sein d’une cohorte de patients et dans des études cliniques, (c) d’identifier les patients ayant un risque de progression rapide de la maladie et (d) d’évaluer l’impact d’un traitement sur la destruction intestinale. Nous avons publié les conditions pour l’élaboration d’un score de destruction digestive dédié à la maladie de Crohn, renommé « score de Lémann », en hommage à son principal concepteur récemment disparu [23]. Ce score est en cours de validation comme critère de jugement dans des études de stratégies thérapeutiques au cours de la MC.
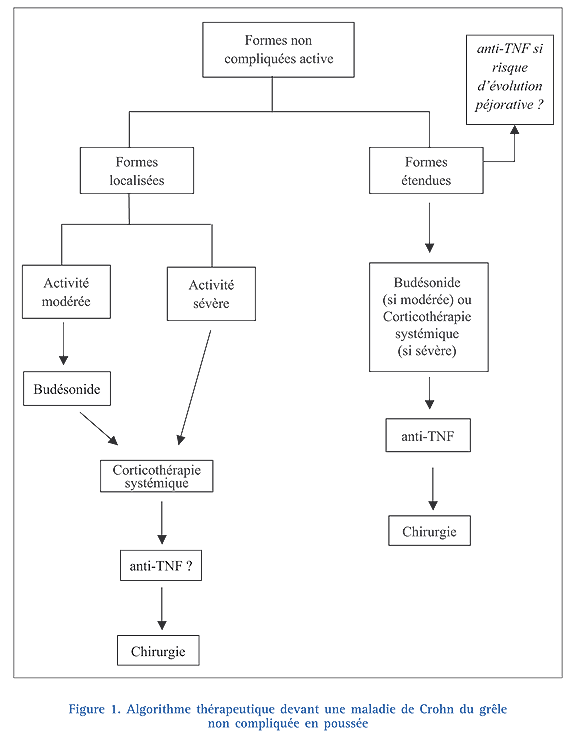
Connaître les particularités thérapeutiques de la maladie de Crohn du grêle (Fig. 1)
Formes inflammatoires non compliquées
Traitement de la poussée (Fig. 1)
Le traitement des formes inflammatoires non compliquées dépend de l’étendue et de la sévérité de la maladie. Chez les patients ayant une atteinte iléo-cæcale localisée avec une activité modérée, le traitement de choix est le budésonide. En cas d’échec du budésonide, une corticothérapie systémique par voie orale ou intraveineuse doit être proposée. Chez les patients ne répondant pas aux corticoïdes, l’utilisation des anti-TNF est préconisée [24]. En cas de maladie sévère, la corticothérapie systémique par voie orale ou intraveineuse est recommandée en première intention. Les anti-TNF restent la meilleure option thérapeutique chez les patients ne répondant pas aux corticoïdes [24]. Néanmoins, certains préfèrent la résection chirurgicale (d’autant plus que les lésions sont peu étendues) à l’utilisation des anti-TNF chez les malades ayant une forme sévère réfractaire aux corticoïdes.
En cas de maladie de Crohn étendue de l’intestin grêle (> 1 mètre), une corticothérapie systémique, associée à l’introduction précoce d’un traitement immunosuppresseur, est recommandée [24]. Chez les patients à risque d’évolution péjorative (patient jeune, nécessité d’une corticothérapie ou présence de lésions ano-périnéales dès le diagnostic…), l’introduction précoce des anti-TNF doit être envisagée, ce d’autant que la majorité des études ont montré une efficacité d’autant plus importante des anti- TNF qu’ils étaient introduits plus tôt dans l’histoire de la maladie [24]. Enfin, dans une étude prospective récente incluant 508 patients atteints de MC modérées à sévères n’ayant jamais reçu de traitement immunosuppresseur ou de biothérapie, un traitement combiné associant l’infliximab à l’azathioprine permettait d’obtenir des taux de rémission clinique sans corticoïde et de cicatrisation muqueuse endoscopique à 6 mois, plus élevés qu’en cas de monothérapie par azathioprine ou infliximal [25]. Un traitement associant les anti-TNF à un immunosuppresseur pourrait ainsi se discuter chez les patients à risque d’évolution péjorative et/ou ayant une atteinte étendue de l’intestin grêle.
Traitement d’entretien (Fig. 2)
L’arrêt du tabac doit être fortement encouragé pour aider au maintien de la rémission chez les patients atteints de MC. En effet, il a été montré que la poursuite du tabac augmentait le risque de récidive, de recours à la corticothérapie et à la chirurgie. Inversement, l’arrêt du tabac améliore significativement l’histoire naturelle de la maladie [26]. Les traitements médicaux non ou peu efficaces pour maintenir la rémission en cas de MC de l’intestin grêle sont aujourd’hui bien identifiés. Les corticoïdes, notamment le budésonide ne sont pas recommandés pour le maintien de la rémission à moyen et à long terme [24, 27]. Les résultats inconstants rapportés dans plusieurs métaanalyses sur l’efficacité des 5-ASA pour le maintien de la rémission ne permettent pas de conclure à l’efficacité de ces traitements [28-30], sauf peut-être dans la situation particulière de la prévention postopératoire [24]. Les traitements dont l’efficacité est bien établie pour le maintien de la rémission incluent l’azathioprine à la posologie de 2-2,5 mg/kg/jour [31, 32] et son équivalent la 6-mercaptopurine (1-1,5 mg/ kg/jour), le methotrexate par voie intramusculaire ou sous-cutané (15 ou 25 mg par semaine) [33, 34] et les anti-TNF (infliximab et adalimumab) chez les patients ayant obtenu une réponse clinique en traitement d’induction [24].
Après avoir obtenu une rémission par corticoïdes systémiques ou budésonide dans le cas d’une première poussée de la maladie, plusieurs facteurs doivent être pris en compte dans la décision d’initier un traitement d’entretien.
L’étendue de la maladie :
- en cas de MC étendue de l’intestin grêle (> 1 mètre), un traitement par azathioprine est indiqué [24] ;
- en cas de MC localisée, l’introduction d’un traitement d’entretien peut être envisagée.
Le profil évolutif et la réponse au traitement de la maladie :
- en cas de rechute, l’introduction d’un traitement par azathioprine est indiquée ;
- en cas de corticodépendance, un traitement par azathioprine ou méthotrexate doit être initié, seul ou en association aux anti- TNF [24] ;
- en cas de rechute sous immunosuppresseurs, l’augmentation de la dose du traitement ou l’introduction d’un anti-TNF doivent être considérés ;
- chez les patients mis en rémission par les anti-TNF, un traitement d’entretien par anti-TNF seul ou associé à un immunosuppresseur est recommandé [25].
Point important, en cas de forme localisée à l’intestin grêle, la chirurgie doit toujours être considérée comme une alternative thérapeutique lors de l’introduction ou de la modification du traitement de la maladie.
La durée du traitement d’entretien reste à l’heure actuelle débattue. Chez les patients en rémission traités par azathioprine, l’arrêt du traitement ne doit se discuter qu’après une période d’au moins 4 ans de rémission, avec la mise en balance au cas par cas des risques et des bénéfices de l’arrêt ou de la poursuite du traitement, d’autant plus qu’il a été montré que le traitement par thiopurine était associé à un risque élevé de développer un lymphome non-Hodgkinien, en particulier chez les patients âgés, de sexe masculin et atteints de MC ancienne [35]. Chez certains patients sous traitement combiné anti-TNF et immunosuppresseur en rémission « profonde », c’està- dire sans aucun signe clinique, biologique, endoscopique et biochimique d’activité, l’arrêt de l’anti-TNF peut être discuté [36].
Formes compliquées (Fig. 3)
Sténoses du grêle
En cas de sténose inflammatoire (évaluée par des données cliniques et iconographiques), le traitement est identique à celui des formes non compliquées (budésonide puis corticothérapie systémique si échec). La place des anti-TNF dans la prise en charge des sténoses intestinales reste débattue : si certains travaux réalisés chez des patients atteints de MC active avec sténose symptomatique ont rapporté un risque élevé de syndrome occlusif chirurgical [37], d’autres plus récents, n’ont pas confirmé de risque particulier en cas de sténose intestinale [38], voire rapporté une efficacité des anti-TNF sur les symptômes obstructifs [39]. Pour mieux définir la place des anti-TNF dans cette situation, une étude prospective du GETAID (CREOLE) est actuellement menée à la recherche de facteurs prédictifs en entéroIRM (et en échographie de contraste) d’échec d’un traitement par anti-TNF (adalimumab) en cas de sténose symptomatique de MC du grêle.
Le traitement des sténoses non inflammatoires symptomatiques fait appel le plus souvent aux techniques endoscopiques (dilatations hydrostatiques) ou à la chirurgie. Le traitement endoscopique s’adresse aux sténoses symptomatiques accessibles par iléocoloscopie, de longueur inférieure à 5 cm, la sténose anastomotique étant l’indication de choix car souvent courte et centrée [40]. Dans une étude récente, 237 dilatations étaient réalisées chez 138 patients ayant une sténose symptomatique [41]. Le taux de succès immédiat en cas de première dilatation était de 97 % avec un taux de complications (perforation et hémorragie) de5 %. À 5 ans, la récidive des symptômes nécessitait une nouvelle dilatation endoscopique et une chirurgie dans respectivement 46 % et 24 %des cas. Schématiquement, le traitement endoscopique permet d’éviter la chirurgie dans près de 50 % des cas. La place des prothèses extractibles reste débattue, et est en cours d’étude avec un nouveau prototype, la principale limite actuelle étant le taux élevé de migrations spontanées précoces des prothèses.
Malgré l’apparition de nouveaux traitements médicamenteux et les progrès de l’endoscopie interventionnelle, la chirurgie reste le traitement de choix des sténoses courtes réfractaires aux corticoïdes.
Traitement des formes fistulisantes de la MC du grêle
À l’heure actuelle, le traitement des fistules intestinales reste chirurgical dans plus de 95 % des cas. En cas de fistule asymptomatique, aucun traitement n’est nécessaire. Le traitement chirurgical est indiqué en cas de fistule symptomatique, notamment en cas de diarrhée et/ou malabsorption dues au court-circuit anatomique créé par la fistule ou en cas de survenue d’un abcès [42]. En cas de fistule iléo-vésicale ou iléo-gynécologique, la résection du segment intestinal pathologique reste la meilleure option thérapeutique, sauf s’il existe un risque de grêle court ou de stomie définitive [42]. Dans le cas des fistules entérocutanée, le traitement chirurgical était la règle jusque récemment. Un travail réalisé par le GETAID a évalué l’efficacité des anti-TNF chez 51 patients atteints de maladie de Crohn sur les fistules entérocutanées traitées par anti-TNF (Setakhr et al. JFHOD 2010). Une fermeture complète de la fistule était obtenue chez un tiers des patients avec une réponse soutenue (suivi médical 36 mois) observée chez la moitié d’entre eux, permettant d’envisager un traitement par anti- TNF dans cette situation jusque récemment éminemment chirurgicale.
Traitement d’un abcès intra-abdominal compliquant une MC du grêle
Prise en charge initiale de l’abcès
La prise en charge initiale consiste à traiter l’infection au moyen d’antibiotiques à large spectre par voie intraveineuse associés à un drainage de la collection abcédée [43]. L’antibiothérapie généralement recommandée en première ligne est une céphalosporine de 3e génération (cefotaxime, ceftriaxone…) associée au métronidazole, pour une durée de 2 semaines si l’abcès est correctement drainé, et peut-être de 3 semaines en l’absence de drainage. Le drainage radioguidé par voie percutanée a démontré son efficacité et sa moindre morbidité par rapport au drainage chirurgical [44], et doit toujours être envisagé, notamment si la collection dépasse 30 à 40 mm de grand axe et est accessible radiologiquement. Dans les autres cas, soit l’antibiothérapie seule est efficace et on en reste là, soit ce n’est pas le cas ou la collection est volumineuse et un drainage chirurgical doit être envisagé. En l’absence d’efficacité de ces mesures, une chirurgie de dérivation doit être envisagée en urgence, principalement afin de contrôler le sepsis. Lorsque l’évolution de cette première phase est favorable sous antibiothérapie plus ou moins drainage, la plupart des auteurs recommandent un contrôle de la résolution complète de l’abcès par imagerie avec retrait du drain dans les quinze premiers jours.
Si cette prise en charge initiale est consensuelle, la suite à donner à cette complication reste controversée, et la proposition d’une résection chirurgicale « systématique » de l’intestin malade à distance n’est proposée que « si nécessaire » dans le dernier consensus ECCQ, traduisant subtilement l’absence de consensus dans cette situation (grade C) [43].
Ainsi, après la résolution de l’abcès, l’exérèse du segment intestinal perforé associée à une anastomose iléocolique 6 semaines après l’épisode initial est recommandée par des experts, notamment en présence de signes obstructifs [24]. En revanche, chez certains patients, en particulier ceux à risque de résection étendue du grêle du fait des caractéristiques de leur affection, un traitement médical peut être envisagé après prise en charge initiale de l’abcès par antibiothérapie et drainage. Cette possibilité de traitement non chirurgical chez les patients atteints d’iléite de Crohn compliquée d’abcès a été évaluée dans plusieurs études rétrospectives, comportant généralement des séries de malades hétérogènes avec des effectifs limités, mais ils montrent que, quasiment avant l’ère des anti-TNF, 46 % (3 %-72 %) des patients pouvaient éviter la chirurgie après la survenue d’un abcès, avec un recul allant de 6 mois à plus de 7 ans [45-47]. Une étude du GETAID (« MICA study ») devrait prochainement débuter et aura pour objectif d’évaluer l’efficacité et la tolérance d’un traitement par anti- TNF débuté immédiatement au décours d’un traitement par antibiotique et drainage radiologique en cas d’abcès abdominal compliquant une MC.
Place de la chirurgie laparoscopique dans le traitement de la MC du grêle
La faisabilité de la laparoscopie dans la MC est une question majeure compte tenu de l’importance des lésions inflammatoires et du caractère itératif des interventions chirurgicales. Avec un taux de conversion en laparotomie inférieur à 10 %, la voie d’abord laparoscopique est maintenant recommandée en première intention dans les formes non compliquées de maladie de Crohn du grêle [48]. Trois facteurs de risque indépendants de conversion en laparotomie ont été identifiés (les poussées itératives de MC, l’existence d’un abcès et l’existence d’une fistule), recommandant une vigilance particulière chez ces malades [49]. À court terme, la laparoscopie permet une diminution de la morbidité globale et de la durée d’hospitalisation, ainsi qu’une accélération de la reprise du transit [48]. À long terme, le taux et le délai d’apparition des récidives de la maladie sont comparables à ceux observés avec la laparotomie. Nous avons récemment publié un travail s’intéressant à la résection laparoscopique des formes compliquées (abcès, fistules, récidive anastomotique) de MC [50]. Aucune différence en termes de mortalité, de morbidité ou de durée d’hospitalisation n’était mise en évidence. En revanche, la durée d’intervention, le taux de conversion et le taux de réalisation de stomie étaient augmentés. Avec une bonne faisabilité, y compris pour les formes compliquées, et un bénéfice en termes de morbidité postopératoire et de durée d’hospitalisation, la voie laparoscopique doit être privilégiée dans la MC.
Conclusion
La MC de l’intestin grêle représente la localisation la plus fréquente de la maladie et est associée à un risque plus élevé de complications de type sténose et perforation intestinale, pouvant aboutir à une résection intestinale. Le risque potentiel de syndrome de grêle court, l’efficacité prolongée des immunosuppresseurs et l’émergence des biothérapies qui permettent d’obtenir, probablement via une cicatrisation endoscopique, une stabilisation prolongée de la maladie, doivent conduire à privilégier un traitement médical, de parvenir à sélectionner précocement dans l’histoire de la maladie les patients présentant un risque potentiel important d’évoluer vers des formes compliquées, justifiant alors l’utilisation précoce des traitements majeurs.
Références
- Colombel JF, et al. [Epidemiology and risk factors of inflammatory bowel diseases]. Bull Acad Natl Med, 2007;191(6):1105-18; discussion 1118- 23.
- Loftus EV. Jr., Clinical epidemiology of inflammatory bowel disease: Incidence, prevalence, and environmental influences. Gastroenterology, 2004.126(6):1504-17.
- Peyrin-Biroulet L, et al. The Natural History of Adult Crohn’s Disease in Population-Based Cohorts. Am J Gastroenterol, 2009.
- Ng SC and Kamm MA. Management of postoperative Crohn’s disease. Am J Gastroenterol, 2008;103(4):1029-35.
- Louis E, et al. Behaviour of Crohn’s disease according to the Vienna classification: changing pattern over the course of the disease. Gut, 2001;49(6):777-82.
- Henriksen M, et al. Clinical course in Crohn’s disease: results of a five-year population-based follow-up study (the IBSEN study). Scand J Gastroenterol, 2007;42(5):602-10.
- Thia KT, et al. Risk factors associated with progression to intestinal complications of Crohn’s disease in a population- based cohort. Gastroenterology, 2010;139(4):1147-55.
- Silverberg MS, et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: Report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol, 2005;19 Suppl A:5-36.
- Cosnes J, et al. Long-term evolution of disease behavior of Crohn’s disease. InflammBowel Dis, 2002;8(4):244-50.
- Schwartz DA, et al. The natural history of fistulizing Crohn’s disease in Olmsted County, Minnesota. Gastroenterology, 2002;122(4):875-80.
- Oberhuber G, et al. Significant association of strictures and internal fistula formation in Crohn’s disease. Virchows Arch, 2000;437(3):293-7.
- Gert Van A, et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Definitions and diagnosis. 2010;4(1):7-27.
- Gasche C, et al. Transabdominal bowel sonography for the detection of intestinal complications in Crohn’s disease. Gut, 1999;44(1):112-7.
- Migaleddu V, et al. Contrast-enhanced ultrasonographic evaluation of inflammatory activity in Crohn’s disease. Gastroenterology, 2009;137(1):43-52.
- Horsthuis K, et al. Inflammatory bowel disease diagnosed with US, MR, scintigraphy, and CT: meta-analysis of prospective studies. Radiology, 2008;247(1):64-79.
- Brenner DJ and Hall EJ. Computed tomography-an increasing source of radiation exposure. N Engl J Med, 2007;357(22):2277-84.
- Desmond AN, et al. Crohn’s disease: factors associated with exposure to high levels of diagnostic radiation. Gut, 2008;57(11):1524-9.
- Zappa M, et al. Which magnetic resonance imaging findings accurately evaluate inflammation in small bowel Crohn’s disease? A retrospective comparison with surgical pathologic analysis. Inflamm Bowel Dis, 2010.
- Dionisio PM, et al. Capsule endoscopy has a significantly higher diagnostic yield in patients with suspected and established small-bowel Crohn’s disease: a meta-analysis. Am J Gastroenterol, 2010;105(6):1240-8; quiz 1249.
- Bourreille A, et al. Role of small-bowel endoscopy in the management of patients with inflammatory bowel disease: an international OMED-ECCO consensus. Endoscopy, 2009;41(7): 618-37.
- van der Heijde DM, et al. Prognostic factors for radiographic damage and physical disability in early rheumatoid arthritis. A prospective follow-up study of 147 patients. Br J Rheumatol, 1992;31(8):519-25.
- Goekoop-Ruiterman YP, et al. Patient preferences for treatment: report from a randomised comparison of treatment strategies in early rheumatoid arthritis (BeSt trial). Ann Rheum Dis, 2007; 66(9):1227-32.
- Pariente B, et al. Development of the crohn’s disease digestive damage score, the Lemann score. Inflamm Bowel Dis, 2010.
- Dignass A, et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Current management. 2010;4(1):28-62.
- Colombel JF, et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med, 2010; 362(15):1383-95.
- Cosnes J, et al. Effects of cigarette smoking on the long-term course of Crohn’s disease. Gastroenterology, 1996;110(2):424-31.
- Benchimol EI, et al. Budesonide for maintenance of remission in Crohn’s disease. Cochrane Database. Syst Rev 2009;21(1):CD002913.
- Steinhart AH, Hemphill D, and Greenberg GR. Sulfasalazine and mesalazine for the maintenance therapy of Crohn’s disease: a meta-analysis. Am J Gastroenterol, 1994;89(12): 2116-24.
- Camma C, et al. Mesalamine in the maintenance treatment of Crohn’s disease: a meta-analysis adjusted for confounding variables. Gastroenterology, 1997;113(5):1465-73.
- Steinhart AH, et al. Systematic review: the potential influence of mesalazine formulation on maintenance of remission in Crohn’s disease. Aliment Pharmacol Ther, 2007;25(12):1389-99.
- Candy S, et al. A controlled double blind study of azathioprine in the management of Crohn’s disease. Gut, 1995;37(5):674-8.
- Lemann M, et al. A randomized, double-blind, controlled withdrawal trial in Crohn’s disease patients in long-term remission on azathioprine. Gastroenterology, 2005;128(7):1812-8.
- Feagan BG, et al. A comparison of methotrexate with placebo for the maintenance of remission in Crohn’s disease. North American Crohn’s Study Group Investigators. N Engl J Med, 2000;342(22):1627-32.
- Ansari A, et al. Further experience with the use of 6-thioguanine in patients with Crohn’s disease. Inflamm Bowel Dis, 2008;14(10):1399-405.
- Beaugerie L, et al. Lymphoproliferative disorders in patients receiving thiopurines for inflammatory bowel disease: a prospective observational cohort study. Lancet, 2009;374(9701):1617-25.
- Louis H and Deviere J. Ensocopicendoluminal therapies. A critical appraisal. Best Pract Res Clin Gastroenterol, 2010;24(6):969-79.
- Louis E, et al. Treatment of small bowel subocclusive Crohn’s disease with infliximab: an open pilot study. Acta Gastroenterol Belg, 2007;70(1):15-9.
- Sorrentino D, Terrosu G and Avellini C. Infliximab in Crohn’s disease: a look at the (not so distant) future. Dig Liver Dis, 2008;40 Suppl 2:S229-35.
- Pelletier AL, et al. Infliximab treatment for symptomatic Crohn’s disease strictures. Aliment Pharmacol Ther, 2009;29(3):279-85.
- Treton X, et al. [Ileal stenosis]. Gastroenterol Clin Biol, 2007;31(4): 387-92.
- Thienpont C, et al. Long-term outcome of endoscopic dilatation in patients with Crohn’s disease is not affected by disease activity or medical therapy. Gut, 2010;59(3):320-4.
- Gert Van A, et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Special situations. 2010;4(1):63-101.
- Van Assche G, et al. The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Special situations. 2010;4(1):63-101.
- Gutierrez A, Lee H, and Sands BE. Outcome of surgical versus percutaneous drainage of abdominal and pelvic abscesses in Crohn’s disease. Am J Gastroenterol, 2006;101(10):2283-9.
- Garcia JC, et al. Abscesses in Crohn’s disease: outcome of medical versus surgical treatment. J Cl i n Gastroenterol, 2001;32(5):409-12.
- Jawhari A, et al. Intra-abdominal and pelvic abscess inCrohn’s disease: results of noninvasive and surgical management. Br J Surg, 1998;85(3): 367-71.
- Lee H, et al. Nonsurgical treatment of abdominal or pelvic abscess in consecutive patients with Crohn’s disease. Dig Liver Dis, 2006;38(9):659-64.
- Tilney HS, et al. Comparison of laparoscopic and open ileocecal resection for Crohn’s disease: a metaanalysis. Surg Endosc, 2006;20(7):1036-44.
- Alves A, et al. Factors that predict conversion in 69 consecutive patients undergoing laparoscopic ileocecal resection for Crohn’s disease: a prospective study. Dis Colon Rectum, 2005;48(12):2302-8.
- Goyer P. et al. Impact of complex Crohn’s disease on the outcome of laparoscopic ileocecal resection: a comparative clinical study in 124 patients. Dis Colon Rectum, 2009;52(2):205-10.
Les 5 points forts
- La maladie de Crohn (MC) de l’intestin grêle représente la localisation la plus fréquente de la maladie et est associée à un risque plus élevé de complications de type sténose et perforation intestinale.
- L’entéroIRM est la technique de choix pour explorer l’intestin grêle en cas de MC, car elle permet de dresser une cartographie des lésions avec une forte précision et n’expose à aucune irradiation.
- Malgré l’apparition de nouveaux traitements médicamenteux, la chirurgie reste le traitement de choix des formes compliquées de MC du grêle localisée et réfractaire aux corticoïdes. Plus de 60 % des patients seront opérés au moins une fois.
- L’avènement des biothérapies permet d’espérer une stabilisation de la maladie chez une majorité de patients, d’autant plus si ces traitements sont introduits tôt dans l’histoire de la maladie.
- L’objectif futur n’est plus de diagnostiquer et de traiter les complications de la maladie lorsqu’elles sont constituées, mais d’identifier au plus tôt, les patients à risque de progression rapide de la maladie afin de proposer, le cas échéant, un traitement précoce (« early ») et majeur (« top-down »).
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION
FMC HGE : Organisme certifié Qualiopi pour la catégorie ACTIONS DE FORMATION